第二章:社區型肺炎
2-7-1 經驗性抗生素使用
加入書籤
重點提要
成人社區型肺炎常見的致病菌以 Streptococcus pneumoniae、Haemophilus influenzae 以及非典型細菌中的 Mycoplasma pneumoniae、Chlamydophila pneumoniae 為主。但要特別小心其它有特殊地域或曝觸史考量的疾病(如肺結核、類鼻疽、Q 熱、恙蟲病等)。在台灣,尚需留意肺炎鏈球菌與黴漿菌對 macrolide 類抗生素產生的抗藥性問題。此外,使用 Fluoroquinolones 作為經驗性治療抗生素有延遲肺結核診斷及增加抗藥性的可能,在高風險病人應審 慎評估後使用。
主編:莊銀清,王復德
副編:王鶴健,柯信國
一、門診治療,低度嚴重度病人(CRB-65=0-1)
加入書籤
(一)無共病,最近三個月未使用過抗生素
在門診治療的低嚴重度病人,可使用單方的 β-內醯胺類抗生素(β-lactam)類或非 β-lactam 類抗生素(如巨環內酯(macrolide)或四環黴素(tetracycline)類)做為處方。選用藥物的原則是依照病人的症狀及病史來決定:以 β-lactam 類治療典型肺炎,或者以非 β-lactam 類抗生素治療非典型肺炎的致病菌(主要考慮黴漿菌及披衣菌)。建議選擇的抗生素及劑量如表 2.7.1.。需提醒的是,以目前台灣對肺炎鏈球菌的流行病學研究,azithromycin 對肺炎鏈球菌的治療已不可靠。
(二)有共病,或最近三個月曾使用過抗生素
若病人有共病、或者在最近三個月曾使用過抗生素,可依病人病徵考慮使用單方、或者 β-lactam 類加上 macrolide 類的合併治療。
二、住院治療,低度嚴重度病人(CURB-65=0-1)
部分病人儘管肺炎相關徵象被歸為低度嚴重度,但可能因其他因素建議住院治療:如共病不穩定、獨居、或難以回診追蹤等非感染相關因素。此類病人選用抗生素原則大致上同門診病人,唯考量已住院之狀況,抗生素使用可採用針劑劑型,尤其是在有腸胃道不適症狀或吸收有疑慮之病人。
三、住院治療,中度嚴重度病人:非加護病房照護(CURB-65=2-3)
中度嚴重度於一般病房照護之病人,建議使用 β-lactam 類加上 macrolide 類的合併治療。β-lactam 類抗生素的建議列於表 2.7.1.。氟喹諾酮類抗生素(Fluoroquinolone, FQ)類抗生素及老虎黴素(tigecycline)列為另選。唯美國 FDA 曾對 tigecycline 發出警訊,以靜脈途徑用於 FDA 核准/非核准適應症時,死亡風險會提高,因此建議在考慮選用 tigecycline 時,照會感染症專科醫師做評估。
針對非加護病房照護的中度嚴重度以上社區型肺炎住院病人,β-lactam 類加上 macrolide 類的合併治療優於 β-lactam 類單一治療(monotherapy)(1B)。
近期有兩個重要的隨機分派臨床試驗(randomized controlled trial, RCT)研究,對於是否應在非加護病房照護的肺炎病人使用抗生素合併治療作出報告。總共分析了 291 位使用 β-lactam monotherapy 抗生素及 289 位合併使用 β-lactam 加 macrolide(BL-M)的病人,在死亡率、轉入加護病房、併發症及住院天數等指標上並無差異;但單用 β-lactam 治療的病人有較高的 30 天內再入院率。在次族群分析中則發現在嚴重度較高的病人(肺炎嚴重度指標 pulmonary severity index ,PSI category IV or CURB-65 score ≥ 2),合併治療有較優性的趨勢(trend toward superiority)。此外,在嚴重度較高及後來確診有非典型致病菌(主要是退伍軍人桿菌屬(Legionella spp.))感染的病人,單用 β-lactam 治療會延遲臨床穩定(clinical stability)的時間 [1]。另一研究比較了單獨使用 β-lactam(656 位病人)、合併用藥 BL-M(739 位病人)、及單獨使用 FQ(888 位病人)三種治療方式,不管在主要指標(90 天死亡率)或各項次要指標(住院天數、併發症)上,單獨使用 β-lactam 皆不劣於 BL-M 及 FQ monotherapy 治療組 [2]。
另外一個統合分析(meta-analysis)研究包含以上兩篇 RCT、一篇非 RCT 的介 入型研究及十一篇觀察型研究,認為在比較 β-lactam monotherapy 和 BL-M 兩 種治療下,唯有在嚴重度較高的社區型肺炎病人中(定義為 PSI category IV or CURB-65 score ≥ 2),BL-M 可以較 β-lactam monotherapy 降低死亡率 [3]。
統合以上較新的 RCT 及 meta-analysis 之結論,本指引做出在肺炎嚴重度較高(CURB-65 score ≥ 2)的狀況下,依照目前實證建議使用 β-lactam 加 macrolide 合併治療可較 β-lactam monotherapy 降低死亡率。至於低嚴重度病人則可考慮單一使用 β-lactam 類抗生素。
四、住院治療,高度嚴重度病人:加護病房照護(CURB-65=4-5)
高度嚴重度於加護病房照護之病人,建議使用 β-lactam 類加上 macrolide 類 或 fluoroquinolone 類的合併治療。建議合併使用的抗生素列於表 2.7.1.。
針對加護病房照護之社區型肺炎病人,合併用藥使用 β-lactam 類加上 macrolide 類(BL-M)還是 fluoroquinolone 類(BL-FQ)抗生素何者較佳,目前尚無定論。在嚴重社區型肺炎需加護病房照護的族群應選擇何種合併治療,目前 並沒有良好證據等級的隨機分派臨床試驗(RCT)可供參考。比較 BL-M 和 BL-FQ 兩種組合在重症病人的治療,兩篇近期的 meta-analysis 各自分析了 17 篇(16684 人,嚴重肺炎病人)[4] 及 8 篇(3873 人,嚴重肺炎病人)[5]觀察型文獻。經分析後發現 BL-FQ 較 BL-M 會有較高的死亡率相關性(相對風險(relative risk, RR): 1.33; 95% 信賴區間(confidence interval, CI): 1.15~1.54; I2 :28%)[4]。而另一篇統合分析研究得到的結論也類似,BL-M 在整體的死亡率較 BL-FQ 低,達到統計意義(19.4% vs. 26.8%:勝算比(odds ratio, OR): 0.68; 95% CI: 0.49 to 0.94; P = 0.02)[5]。但此兩篇統合分析所含的 25 篇文獻中,有 16 篇有高誤差風險(high risk for bias),且只有 11 篇有包含加護病房的病人族群。此兩篇皆因無 RCT 可被納入分析且具有嚴重誤差風險,在 GRADE 評比上皆為非常低證據品質。
綜合以上證據,BL-M 合併治療在需加護病房收治的嚴重社區型肺炎患者較 BL-FQ 可降低死亡率。唯目前無 RCT 可作良好佐證而證據品質非常低,且以上文獻多未著墨 macrolide 劑型為針劑或口服的比例。考慮國內 macrolide 皆為口服劑 型而重症病人可能有藥物吸收不穩定之考量,因此 BL-M 及 BL-FQ 仍建議並列為治療選擇。
五、其他特殊考量
若病人有綠膿桿菌(Pseudomonas aeruginosa)、抗甲氧苯青黴素抗藥金黃色葡萄球菌(methicillin-resistant Staphylococcus aureus, MRSA)感染風險、或吸入性肺炎等特殊考量,建議使用的抗生素列於表 2.7.1.的 「特殊考量」。
六、治療時間及降階治療的時機
(一)縮短治療天數:如達到臨床穩定狀態
在輕至中嚴重度肺炎,抗生素療程5~7天為安全且有效
在高嚴重度肺炎,抗生素療程7天為安全且有效
在輕至中度嚴重度的社區型肺族群,已有多篇 RCT 證實 5~7 天的治療天數是安全且有效的。有兩篇 meta-analysis 分析了各 15 篇(比較 ≤ 7 天及 > 7 天的療程)[6] 及7篇的 RCT(比較 3~7 天及 7~10 天的療程)[7],較短的治療天數相較於延長治療,不論在安全性或有效性上都沒有差異 。最新的 RCT 為 2016 年發表在西班牙進行的多中心研究,共收錄了 312 位病人,研究結果顯示在達到臨床穩定的狀況下(請見表 2.7.1.註解 b)5 天的療程是安全的。此篇研究不只分析了治療成功率、死亡率,也評估了肺炎相關症狀達到緩解的程度以及 X 光的表現,在延長治療以及 5 天療程的組別比較起來並無差異。此研究排除了護理之家的住民、14 天內有入住急性醫療單位的病人、可能需要較長療程的致病菌(金黃色葡萄球菌及綠膿桿菌)、以及較嚴重程度的複雜感染(心內膜炎、腦膜炎、需胸管引流治療)。值得注意的是其中有 38.8%(121 人)為 PSI category IV~V 的嚴重病人,提供了嚴重肺炎應也有機會短程治療的證據。此外,幾乎 80% 的病人是接受 FQ 的治療,而 FQ 為一般劑量而非高劑量 [8]。
本指引將一篇在 2016 年發表的 RCT [8]和上述兩篇 meta-analysis [6][7]中的 RCT 做了整併及次族群分析,發現 ≤ 7 天及 > 7 天的抗生素療程,不論是使用何種類型的抗生素(β-lactam、macrolide、或 FQ)、以及使用口服或針劑劑型,在臨床治療成功率上皆無差異。
在高嚴重度肺炎的族群中只有一篇前瞻性觀察型文獻可供參考,在 328 位 CURB-65 score 3~5 分的病人中,療程七天及大於七天相比較,在各項主要及次要指標上並無差異 [9]。
依照過去的治療指引建議,社區型感染肺炎需至少治療 5 天且需達到退燒 48~72 小時且臨床狀況穩定 [10]。於 2016 年也有一篇隨機對照試驗顯示這樣的治療 建議是安全且有效的 [8]。 由於大多數的病人在 3~7 天內可以達到臨床穩定的狀態 [10], 因此我們建議在一般的情況下,給予社區型感染肺炎 5~7 天的抗生素治療。若是病人狀況穩定,也建議將靜脈注射藥物降階為口服藥物治療 [11]。但若是病人一開始使用的抗生素是沒有效的、抗甲氧苯青黴素抗藥金黃色葡萄球菌(Methicillin-resistant Staphylococcus aureus, MRSA)引起之肺炎、或是其他較少見的致病菌引起之肺炎(如類鼻疽伯克氏菌或是黴菌),則可視菌種延長治療時間。
(二)抗生素針劑換為口服劑型:如達到臨床穩定狀態,在輕至重度嚴 重度肺炎,2~4 天轉換為口服抗生素為安全且有效(1B)
不論肺炎嚴重度,多篇 RCT 已證實,治療 2~4 天後由針劑轉換為口服劑型是有效且安全的。一篇 meta-analysis 收錄了 6 篇 RCT 共 1219 位病人,結論顯示提早於 2~4 天將抗生素改為口服劑型在療效(包括治療成功率、死亡率或感染復發率)與繼續使用注射劑型並沒有差異,且可大幅縮短住院天數達 3.34 天 [11]。本指引依照使用抗生素種類的不同,重新進行治療成功率之次族群分析,無論是使用 β-lactam 或 fluoroquinolone,仍得到無差異的結果。
七、Fluoroquinolone 經驗性療法有延遲肺結核的診斷及增加抗藥性的風險,在臨床已懷疑結核感染的病人應審盛評估後使用(2C)
直至 2015 年,台灣結核病發生率為每十萬人口 45.7 人,是結核病中度負擔國家。使用 fluoroquinolone 是否會影響肺結核的診斷及抗藥性一直都是備受討論的議題。有兩篇 meta-analysis 分析了 9 篇(4 篇美國、2 篇韓國、2 篇台灣、1 篇加拿大:含一篇前瞻性及八篇回溯性)[12] 及 6 篇(2 篇美國、1 篇韓國、1 篇台灣、1 篇加拿大、1 篇南非:全為回溯性)[13]文獻,得到類似的結論。認為診斷結核前使用fluoroquinolone會增加抗藥性的風險,勝算比(odds ratio)各為 2.7(95% CI 1.30 5.60)[12]和 2.81(95% CI 1.47 5.39)[13],且和延遲診斷有相關性(平均延遲 19.03 天)[12]。因此在臨床上有結核感染疑慮的病人,應謹慎審視胸部X光及病史,若已有結核感染之可能性,建議審慎評估後使用 fluoroquinolone 作為肺炎經驗性治療的抗生素。
八、本節重要臨床問題
| GRADE 建議等級 | 臨床建議內容 | 參考文獻 |
|---|---|---|
| 1B | 在非加護病房照護的住院病人,建議在中度嚴重度以上的病人,使用 β-lactam 類及 macrolide 類抗生素合併用藥治療(combination therapy),優於 β-lactam 單一治療(monotherapy) | [1][2][3][14] |
| 1B | 如達到臨床穩定狀態,在輕至中嚴重度肺炎,抗生素療程 5~7 天為安全且有效 | [6][7][8] |
| 2C | 如達到臨床穩定狀態,在高嚴重度肺炎,抗生素療程 7 天為安全且有效 | [9] |
| 1B | 如達到臨床穩定狀態,在輕至重度嚴重度肺炎,在針劑抗生素治療 2~4 天後轉換為口服抗生素為安全且有效 | [11] |
| 2C | Fluoroquinolone 經驗性療法有延遲肺結核的診斷及增加抗藥性的風險,在臨床已懷疑結核感染的病人應審慎評估後使用 | [12][13] |
表 2.7.1 社區型肺炎經驗性抗生素建議
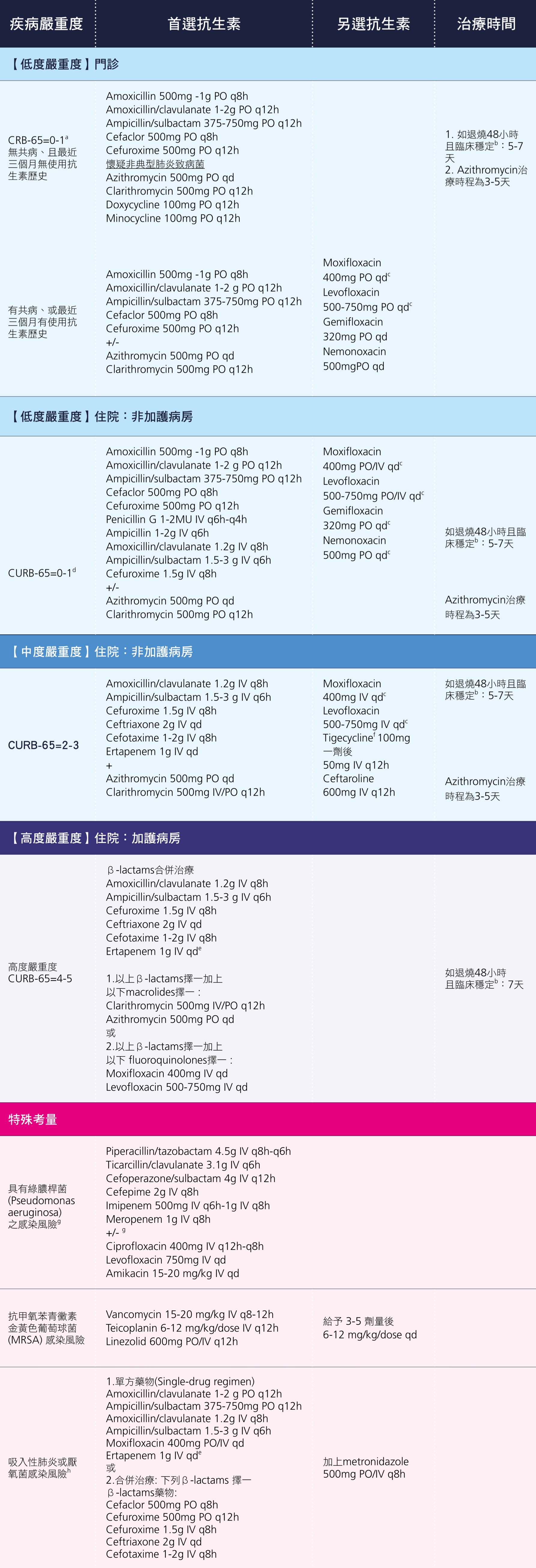 註解:
註解:
- a. 針對門診治療的病人,使用簡易的 CRB-65(simplified CRB-65)作為嚴重度 指標值。
- b. 臨床穩定狀態定義為:體溫 ≤ 37.8°C;心跳 ≤ 100 跳/每分鐘;呼吸速率 ≤ 24 次/分鐘;收縮壓 ≥ 90 mm Hg;未使用氧氣時的血氧濃度 ≥ 90% 或 pO2 ≥ 60 mm Hg;能穩定地由口進食;正常意識狀態(最後兩項為出院或改為口服抗生素需考慮之條件;並非用來判斷感染治療無效之標準)。
- c. 使用 levofloxacin 及 moxifloxacin 作為肺炎的經驗性療法,有機會造成肺結核診斷的延遲及增加結核菌 fluoroquinolone 抗藥性的風險。在臨床懷疑肺結核或已知有肺結核風險的病人,應避免使用 levofloxacin 及 moxifloxacin 直到排除肺結核的診斷。此外,gemifloxacin 及 nemonoxacin 對肺結核皆無療效。 但是,使用這兩種 quinolones 是否會對結核治療造成影響,需要更進一步的研究才能下定論。
- d. 並非因疾病嚴重度相關因素住院,如:獨居、無法回診追蹤、共病不穩定。
- e. 在有腸內菌(Enterobacteriaceae)感染風險的病人,尤其是有 ESBL 抗藥性之考量、且無 P. aeruginosa 感染風險時,可考慮使用 ertapenem。
- f. 美國 FDA(Food and Drug Administration)曾針對 tigecycline 發出警訊,以靜脈途徑用於 FDA 核准 / 非核准適應症時,死亡風險會提高。因此建議在考慮選擇 tigecycline 時,建議照會感染症專科醫師做評估。
- g. 在治療有 P. aeruginosa 感染風險的病人時(多重抗藥性菌種的危險因子,請參考表第二章第一節之三),可考慮使用合併治療避免因抗藥性造成治療失敗。但是一旦有確認的藥物敏感性試驗報告,就應該降階為有效的單一療法。
- h. 在此部分選用抗生素的建議,同於前面表格所示,依照疾病嚴重度做為選擇抗生素的憑據。
2-7-2 已知病源菌之治療
加入書籤
見表 2.7.2
一、社區型肺炎之革蘭氏陰性菌種個論
流感嗜血桿菌(Haemophilus pneumoniae)
流感嗜血桿菌可分為 typeable form 和 nontypeable form。呼吸道疾病主要由 nontypeable form 所導致,臨床上約有 25-50% 產生 β-lactamase,對 ampicillin 抗藥。在德國 CAPNETZ 的世代研究中,在 2790 個有確定病原菌的社區型肺炎中,流感嗜血桿菌占 6.3%。流感嗜血桿菌造成的肺炎,27.8% 會同時合併其他細菌感染。單一由流感嗜血桿菌造成的肺炎,病人的臨床特徵包括膿痰、肺炎球菌疫苗接種、合併慢性呼吸道共病。臨床治療反應,使用 β-lactam 類及 macrolide 類抗生素合併用藥治療和單一治療相當(85.9% vs.88%)。但 fluoroquinolone 的治療效果最好(96.7%),macrolide 的單一治療效果最差(70%)。整體而言,14 天的治療成功率為 91.9% [15]。在台灣,根據 Taiwan Surveillance of Antimicrobial Resistance(TSAR)的研究資料顯示,2004-2010 年所分析的流感嗜血桿菌,平均對抗生素的抗藥性比例分別為:ampicillin(56%)、amoxicillin/clavulanate(4.2%)、amoxicillin/sulbactam(22.9%)、ceftriaxone(2.7%)、cefuroxime(16.1%)、tetracycline(33.4%)、imipenem(3.0%)、clarithromycin(48.5%)、levofloxacin(12.5%)(但抗藥性從 2004 年的 2.0% 增加到 2010 年的 24.3%)[16]。在 2003 年的研究顯示,台灣的流感嗜血桿菌 60% 對 ampicillin 有抗藥性,40% 對 clarithromycin 有抗藥性,但對 azithromycin 皆無抗藥性 [17]。因對 ampicillin 有高抗藥性,因此不建議經驗性治療使用 ampicillin。對於有產生 β-lactamase 的流感嗜血桿菌,治療建議使用第二、三代 cephalosporin 或 fluoroquinolone。卡他莫拉菌(Moraxella catarrhalis)
/ 在台灣收集 2001-2004 年的卡他莫拉菌中,97.8% 產生 β-lactamase。 Ampicillin 的抗藥性高達 97.8%。所有菌株對 amoxicillin/clavulanate、 cefixime、ciprofloxacin、erythromycin、levofloxacin、moxifloxacin 都具有感受性 [18]。因對 ampicillin 有高抗藥性,因此不建議經驗性治療使用 ampicillin。治療首選建議為 amoxicillin/clavulanate。革蘭氏陰性腸桿菌科(Gram-negative Enterobacteriaceae)
在亞洲地區,由革蘭氏陰性菌造成的社區型肺炎中,最常見的是肺炎克雷伯氏菌(Klebsiella pneumoniae),約佔 6.3%。在台灣,克雷伯氏肺炎菌也是最常見造成社區型肺炎菌血症的主要原因,死亡率高於肺炎鏈球菌。關於革蘭氏陰性腸桿菌造成社區型肺炎的相關治療證據十分有限。在 2004 年發表的一篇雙盲隨機分派臨床試驗中,比較在成人中度至重度社區型肺炎患者中,ertapenem 和 ceftriaxone 療效,其中兩者療效相當,都可以達到超過 90% 的治癒率。其中 ertapenem 對於克雷白氏菌屬(Klebsiella spp)、大腸桿菌(E. coli),和陰溝腸桿菌(Enterobacter cloacae)的治癒率都可以超過 87.5% [19]。另外,對於在專業護理機構或重症加護病房以外的醫院環境中獲得肺炎的成人,最常見的病原體是腸桿菌 科(Enterobacteriaceae),約佔 19.5%。Ertapenem 相較於 cefepime,對於上述病人肺炎的治療效果相當,分別是 87.3% 和 86% [20]。綠膿桿菌(Pseudomonas aeruginosa)
由綠膿桿菌所導致的社區型肺炎,發生率很低。評估可能由綠膿桿菌所導致的社區型肺炎的危險因子包含以下:近期住院,最近 3 個月內有使用抗生素,過去有嚴重的肺部疾病(用力呼氣一秒量 FEV1<30%),口服類固醇的使用(最近兩週每天劑量超過 10mg)。對於評估有上述綠膿桿菌危險因子的病人,社區型肺炎的治療應合併抗綠膿桿菌(anti-pseudomonal)β-lactams 加上 fluoroquinolone(ciprofloxacin or levofloxacin)或加上 aminoglycoside。一開始加上兩種抗綠膿桿菌藥物治療,以減少治療不足的機會。一旦確定菌株及藥物敏感測試後,建議抗生素降階為單一處方治療。至於 macrolide 的免疫調節作用對於綠膿桿菌所導致的社區型肺炎是否有益處,目前是存在爭議的。在一篇回溯性的研究中,入院 48 小時內加入 macrolide 的治療並無法減低綠膿桿菌所導致的社區型肺炎病人的 30 天死亡率 [21]。類鼻疽伯克氏菌(Burkholderia pseudomallei)
類鼻疽伯克氏菌的治療的治療包跨括兩階段:初始強化治療(intensive phase)和根除治療(eradication therapy)。類鼻疽伯克氏菌天生就對 penicillin,ampicillin,第一代和第二代 cephalosporins,gentamicin,streptomycin,和 polymyxins 有抗藥性。然而多數菌株對於新一代 β-lactams,ceftazidime,imipenem,meropenem,piperacillin,amoxicillin–clavulanate,ceftriaxone 和 cefotaxime 有敏感性。治療類鼻疽在最一開始的初始強化治療階段,必須投予至少 14 天的 ceftazidime,meropenem 或 imipenem。對於重症患者和廣泛的肺部疾病,深部器官膿腫,骨髓炎,化膿性關節炎和神經性類鼻疽需要更長時間的初始強化治療。在 1989 年,在泰國的隨機分派臨床試驗中,比較 ceftazidime 和 傳統藥物治療(chloramphenicol,doxycycline,trimethoprim 和 sulfamethoxazole)對於類鼻疽初始強化治療階段的療效,發現 ceftazidime 可以 降低 50% 的死亡率。隨後的研究中,又比較高劑量 imipenem(50 mg/kg/ day),發現 imipenem 和 ceftazidime 兩組的死亡率相當,但 imipenem 似乎有比較低的治療失敗率。之後在澳洲的一篇觀察性研究中,發現對於較重症的類鼻疽患者,meropenem 的治療預後優於 ceftazidime [22]。另外,在嚴重休克的類鼻疽感染時,為了克服此時嗜中性白血球的功能缺陷,有些觀察性的研究指出,加 上人類顆粒性白血球聚落刺激因子(granulocyte colony-stimulating factor, G-CSF),可以減少病人的死亡率。在最初強化治療階段治療後,隨後的根除治療被認為是預防類鼻疽復發所必需的。Trimethoprim-sulfamethoxazole(TMP-SMX)是根除治療的首選用藥。在泰國的一篇雙盲隨機分派臨床試驗中,比較 TMP-SMX 單獨治療和 TMP-SMX 加上 doxycycline,口服 20 週的類鼻疽根除治療,發現 TMP-SMX 單獨治療的復發率與 TMP-SMX 加上 doxycycline 相當(復發率分別是 5% 和 7%)[23]。 Amoxicillin- clavulanate 和 doxycycline 的治療則是在病人無法耐受 TMP-SMX 或有使用禁忌 時的二線治療。目前根除階段的治療建議是 3 至 6 個月為原則。
二、社區型肺炎之革蘭氏陽性菌種及非典型菌種個論
肺炎鏈球菌(Streptococcus pneumoniae)
針對肺炎鏈球菌所造成的社區型肺炎,並無相關的 RCT 去比較不同抗生素的治療效果。在一些大型的觀察性研究結果顯示,表中所列抗生素(如 penicillin、 penicillin derivative、第二或第三代 cephalosporin、macrolide、FQ 或 tetracycline)的治療效果並無顯著差異。若針對多重抗藥性肺炎鏈球菌肺炎,經驗性使用 levofloxacin,moxifloxacin 或 azithromycin 亦有不錯的臨床反應,但後續仍應根據藥物敏感性試驗結果做抗生素的選擇及用藥的調整 [24]。若病人合併有菌血症或休克、呼吸衰竭等狀況,可考慮合併兩種抗生素治療。在一個前瞻性的觀察性研究(共分析了844位肺炎鏈球菌肺炎併發菌血症的成人患者)中發現,在病況嚴重的病人合併兩種以上的抗生素治療有較佳的 14 天存活率 [25]。而在此研究中,合併使用的藥物包括 β-lactam 加上 macrolide(如 azithromycin)或加上 FQ(levofloxacin 或 moxifloxacin),或是根據敏感性試驗報告選擇兩種有效的藥物合併治療。
在治療天數方面,若是針對無併發症產生且對藥物反應佳的病人,建議 5-7 天,但若合併有菌血症則需延長至 10~14 天為原則,同時必須確認沒有併發其它部位的感染(如腦膜炎、心內膜炎、感染性關節炎、膿胸等)後才可停用抗生素。
金黃色葡萄球菌(Staphylococcus aureus)
針對抗甲氧苯青黴素敏感金黃色葡萄球菌(methicillin-susceptible S. aureus, MSSA)肺炎,oxacillin/flucloxacillin 或第一代 cephalosporin 是治療的首選。若培養報告顯示為 methicillin 抗藥性金黃色葡萄球菌(MRSA),則使用醣肽類(glycopeptides)萬古黴素(vancomycin)或壁黴素(teicoplanin)或 linezolid 在臨 床反應率或死亡率均無顯著的差別 [26]。但因為 MRSA 對 vancomycin 的 MIC 有逐年升高的趨勢且 MIC 值與治療失敗率有明顯的正相關,一般建議在 vancomycin MIC ≧ 2μg/mL 的狀況下,linezolid 就會是一個比較適當的選擇。除此之外,linezolid 在一些動物實驗中也發現可以有抑制毒素產生的效果。在副作用方面,使用 linezolid 有較高的機會產生骨髓抑制及腸胃道的不良反應,而使用 glycopeptides 則發生腎毒性的比例較高。黴漿菌(Mycoplasma pneumoniae)、肺炎披衣菌(Chlamydophila pneumoniae)
黴漿菌及肺炎披衣菌為造成非典型肺炎常見的病原體,一般而言症狀較輕微,目前並無 RCT 針對以上菌種做各類抗生素治療效果的比較,但在某些社區型肺炎(致病菌種包含上述非典型細菌)經驗治療的臨床試驗研究結果顯示,使用 macrolides(azithromycin 或 clarithromycin)、tetracyclines(doxycycline 或 minocycline)或 respiratory FQs(如 levofloxacin 或 moxifloxacin)均有不錯的效果。但是,值得注意的是在許多地區(特別是亞洲),macrolide-resistant Mycoplasma 的比例頗高(在一個中國大陸發表的研究,其抗藥比例可達 95%)[27], 在此狀況下,tetracyclines(doxycycline 或 minocycline)或 respiratory FQs(如 levofloxacin 或 moxifloxacin)就會是一個好的替代選擇。退伍軍人桿菌(Legionella species)
一般認為 macrolides(特別是 azithromycin)或 respiratory FQs(特別是 levofloxacin)均有不錯的效果。針對退伍軍人桿菌,一樣沒有 RCT 去比較不同藥物的治療效果,不過根據 2014 年一個 meta-analysis 分析 12 篇臨床研究結果顯示,使用 FQ 相較於使用 macrolide 有較低的死亡率及較短的住院天數 [28]。不管使用何種藥物治療退伍軍人桿菌肺炎,建議治療天數為 7~10天為原則,若病人為免疫功能較差或病況嚴重,治療可延長至 21 天。
表 2.7.2 社區型肺炎已知菌種抗生素建議
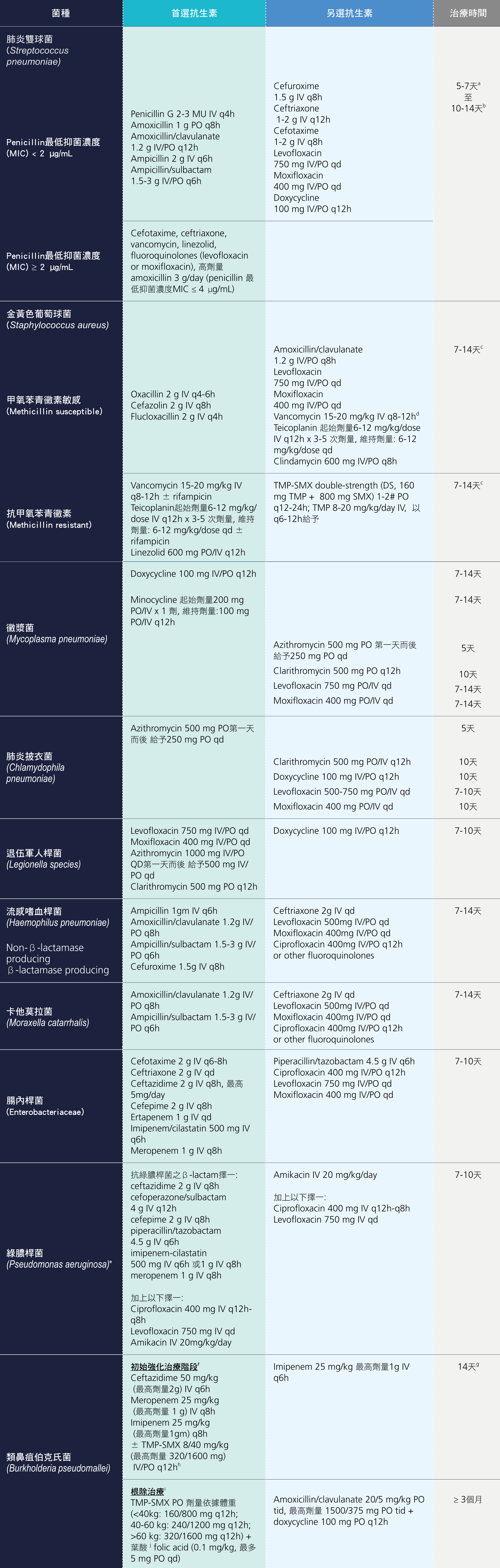 註解:
註解:
- a. 病人若臨床穩定且退燒超過 48 小時。
- b. 病人若合併有肺炎鏈球菌菌血症。
- c. 病人若合併有金黃色葡萄球菌菌血症,則可考慮延長抗生素治療至 4 星期。
- d. 在免疫功能不全病人,vancomycin 給藥頻次建議每 6 小時給予一次。
- e. 綠膿桿菌所導致的社區型肺炎的危險因子包含以下:近期住院,最近 3 個月內有 使用抗生素,過去有嚴重的肺部疾病(用力呼氣一秒量 FEV1<30%),口服類固醇的使用(最近兩週每天劑量超過 10mg)。
- f. 如病人有敗血性休克可考慮使用顆粒性白血球聚落刺激因子(granulocyte colony-stimulating factor,G-CSF)300 μg IV 十天
- g. 若病人病況危急、有嚴重肺炎、深部感染、器官膿瘍、骨髓炎、感染性關節炎、中樞神經感染等情況,則治療可延長至 4 至 8 週或更久。
- h. 若是併有深部感染如中樞神經感染,建議加上 TMP-SMX 一起使用。
- i. 對 sulfonamides 過敏者可使用 amoxicillin/clavulanate。
- j. 葉酸(Folic acid)可以減少或預防 TMP-SMX 所造成之 anti-folate 的副作用但卻不影響 TMP-SMX 的殺菌力。
2-7-3 特殊病原菌之治療
加入書籤
重點提要
社區型肺炎的病原菌若非一般常見細菌時,其治療須多方面考量,包含依據病人族群以及臨床情境以選擇適切的治療策略及藥物選擇,必要時請照會感染科醫師、胸腔重症醫師、藥師與相關專家。流感肺炎絕大多數是在社區感染,社區發作,可能影響健康人、也可能發生在免疫不全病人、或安養中心住民。肺囊蟲肺炎與巨細胞病毒肺炎則主要發生於免疫不全病人,若原本健康的人被診斷出此類疾病時應積極進一步尋找宿主可能之影響免疫的疾病。
主編:陳宜君
副編:趙文震
一、已知病原菌治療建議說明
本章節主要就社區型肺炎病人已知病原菌提出抗微生物製劑之建議,我們分別就流感肺炎(表 2.7.3.1.)、肺囊蟲肺炎(Pneumocystis jirovecii pneumonia, PCP)(表 2.7.3.2.)與巨細胞病毒肺炎 Cytomegalovirus(CMV)pneumonia(表 2.7.3.3.)針對其臨床治療建議及對應之證據與建議等級彙整於上述表格。隱球菌(Cryptococcus neoformans)與麴菌(Aspergillus)肺炎之治療請參照 2016 台灣侵襲性真菌感染病人抗真菌製劑應用指引 [29]。
(一)流感肺炎之治療建議
肺炎為流感併發症臨床表現之一,對於流感併發症治療選擇上本指引提出首選與另選抗流感病毒藥物,亦針對特殊藥物之使用方式與特殊適應症提出說明與建議。此外我們亦針對抗流感病毒藥物使用時機、劑量與療程提出說明與建議(表 2.7.3.1.)。須注意流感病人有危險徵兆或為高風險族群即應使用抗病毒藥物,且不應以快篩陰性而排除流感與早期抗病毒藥物給予,公費流感抗病毒藥物使用對象請參照當年度疾病管制署相關規定 [30]。
(二)肺囊蟲肺炎(Pneumocystis pneumonia, PCP)
肺囊蟲肺炎是一黴菌(Pneumocystis jirovecii )造成的感染,過去研究族群主要以愛滋病毒感染病人為主。依據肺囊蟲肺炎感染病人不同嚴重程度之首選與另選抗生素與類固醇使用劑量提出建議,此外也對風險族群之定義提出說明並針對風險族群之初級與次級預防用藥提出建議(表 2.7.3.2.)。
(三)巨細胞病毒(CMV)肺炎
巨細胞病毒肺炎治療情境包含確診後之治療(definitive therapy)、先發治療(pre-emptive therapy)與預防(prophylaxis),以下就不同治療情境之首選與另選藥物提出說明與建議(表 2.7.3.3.)。
二、流感肺炎的治療
有關流感肺炎建議用藥綜整如下表,相關說明請參照下列註解。
表 2.7.3.1 流感肺炎建議用藥、劑量與療程 a

- a. 抗流感病毒藥物使用時機
- 感染流感病毒後,大多數人可自行痊癒;流感併發症病人之治療除了支持療法,必要時可給予抗病毒藥劑治療。
- 針對已出現流感危險徵兆(包括呼吸急促、呼吸困難、發紺、血痰、胸痛、意識改變、低血壓),或流感併發症高風險病人出現類流感症狀,應考慮給予抗流感病毒治療。
- 當決定給予抗病毒藥劑治療,就應儘快給予,不需等到檢驗確診才給藥。
- 研究顯示症狀開始後 48 小時內開始治療,療效最佳。然而有些研究顯示對住院病人症狀超過 48 小時才投予 oseltamivir 仍有縮短住院天數或減低死亡率的助益 [31]。
- b. Oseltamivir(Tamiflu)
- c. Peramivir(Rapiacta)
- d. 抗流感藥物劑量
- e. 抗流感藥物療程
三、肺囊蟲肺炎的治療和預防
有關肺囊蟲肺炎建議用藥綜整如下表,相關說明請參照下列註解。
表 2.7.3.2 肺囊蟲肺炎(PCP)治療說明與建議 a,b
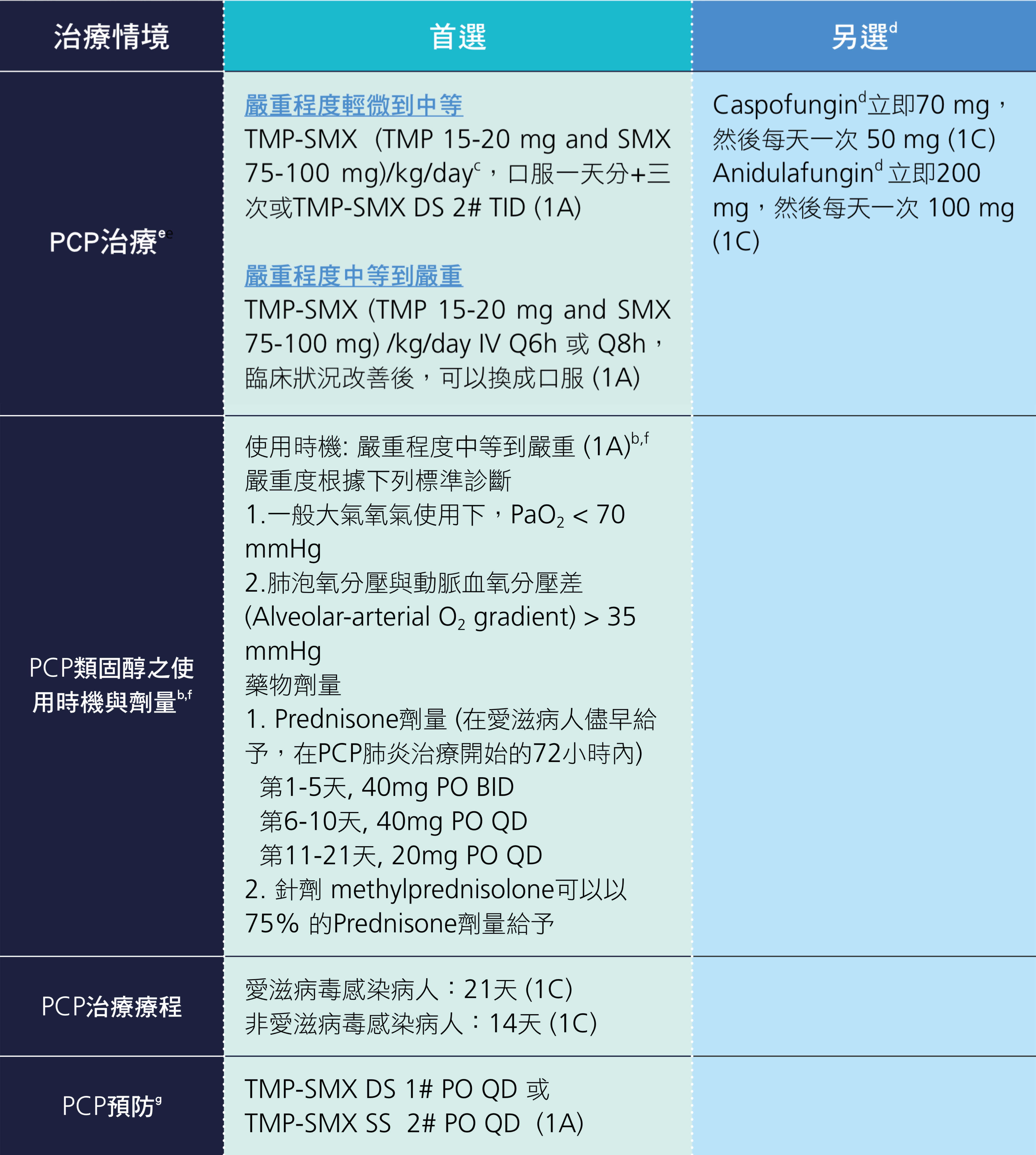 縮寫
縮寫
DS:double strength(雙倍劑量 TMP 160mg/SMX 800mg);SS:single strength(單倍劑量 TMP 80mg/SMX 400mg);TMP-SMX:trimethoprim-sulfamethoxazole
- a. 治療建議以愛滋病毒感染病人的研究為主。
- b. 類固醇之建議劑量主要以愛滋病毒感染病人的研究為主,在其它病人族群是否適用目前仍無足夠證據 [42]。
- c. TMP-SMX 可能發生的副作用包括肝毒性 [43],使用 TMP 12 mg/kg/day 的病人發生急性精神病(acute psychosis)的發生率較低 [44]。
- d. 因國內無法取得 pentamindine,primaquine,TMP 單方,故當病人為蠶豆症(Glucose-6-phosphate dehydrogenase(G6PD)deficiency)無法使用 TMP- SMX,或發生 TMP-SMX 的副作用時,肺囊蟲肺炎的另類選擇可考慮 echinocandins [45][46]。
- e. 除未使用高效能抗病毒藥物之免疫低下(CD4 數小於 200 cells/mm3)的愛滋病毒 感染病人外,其他罹患肺囊蟲肺炎的危險族群為罹患血液腫瘤病人,器官移植患者,罹患發炎疾病者(如 granulomatosis with polyangiitis,polymyositis/ dermatomyositis),實體瘤(solid tumors),還有其他狀況 [42]。
- f. 使用類固醇的情況下,需小心巨細胞病毒活化發生巨細胞病毒肺炎,和其他類固醇相關副作用。因東方人體型較小,類固醇劑量可考慮減半。
- g. 肺囊蟲肺炎的預防
需考慮肺囊蟲肺炎預防性用藥的病人如下:初級預防
- 未使用高效能抗病毒藥物之愛滋病毒感染病人且其CD4數小於 200 cells/ mm3,口咽念珠菌感染 [47][48]。
- 非愛滋病毒感染之免疫不全病人,若感染肺囊蟲肺炎的風險大於 6%,建議使用 [49]。
- 若免疫不全病人接受類固醇劑量一天大於 20mg prednisone 超過一個月 [50][51]。
- 接受 alemtuzumab 的病人建議使用肺囊蟲肺炎預防藥物在完成 alemtuzumab治療後,至少兩個月,或直到 CD4 數大於 200 cells/mm3,看何者較晚達到 [52][53]。
- 接受 temozolomide 和放射治療的病人,建議使用肺囊蟲肺炎預防藥物至到淋巴球低下(lymphopenia)恢復 [52][54]。
- 異體造血幹細胞移植病人在幹細胞植入後,看繼續使用免疫抑制劑的時間,可給予肺囊蟲肺炎預防藥物。預防藥物建議六個月,若需繼續使用藥物治療移植物對抗宿主疾病(graft-versus-host diseases)可考慮預防更久 [55]。
- 特定異體造血幹細胞移植病人需使用較高劑量之化學藥物,或使用含有普林(purine)類似物,(如 fludarabine,claribine)或高劑量類固醇者,像是淋巴癌,多發性骨髓瘤患者,或血癌患者 [55]。
- 器官移植病人通常在移植後使用 6 個月到一年的時間,或者當免疫抑制劑劑量增強時(如治療急性移植排斥時)。肺部移植病人通常建議接受終身的肺囊蟲肺炎預防藥物使用 [56]。
- 其他原發性免疫缺陷病人(如嚴重聯合免疫缺陷(severe combined immunodeficiency),自發性 CD4 淋巴細胞減少症(idiopathic CD4 T-lymphocytopenia),高免疫球蛋白M症候群(hyper-IgM syndrome)[57]。
- 病人接受含有普林(purine)類似物(如 fludarabine)並合併使用 cyclophosphamide [52]。
次級預防
愛滋病毒感染病人且曾有肺囊蟲肺炎病史。但於服用高效能抗病毒藥物至 CD4 數大於 200 cells/mm3超過三個月,可停止肺囊蟲肺炎次級預防 [58][59]。
四、巨細胞病毒肺炎的治療
有關巨細胞病毒肺炎建議用藥綜整如下表,相關說明請參照下列註解。
表 2.7.3.3 巨細胞病毒(Cytomegalovirus)肺炎治療說明與建議
 縮寫
縮寫
CMV, cytomegalovirus;PCR, polymerase chain reaction.
- a. 另選藥物須考量下列狀況:所處醫療機構抗藥狀態、過敏史、藥物動力學相關資訊、首選藥物是否無效或產生副作用、是否於接受或曾接受首選藥物下產生之突破性(breakthrough)感染與首選藥物可近性。
- b. 免疫健全病人一般不建議使用抗病毒藥物;免疫不全患者則建議於 CMV 感染導致視力損傷或其他危急生命之症狀時使用抗病毒藥物。
- c. 對於造血幹細胞移植病人與器官移植患者之 CMV 感染需多面向評估與治療(1C),例如建議降低免疫抑制藥物(如類固醇)之使用 [60][61][62][63](1B)。
- d. 治療療程:造血幹細胞移植病人建議在 3-4 週之誘導治療(induction therapy)後 加上 4 週之維持治療(maintenance therapy)[64]。器官移植病人建議治療至病毒檢測確認病毒清除後至少兩週 [62](1B)。
- e. Ganciclovir 劑量於腎功能正常且無嚴重肝功能不全之嚴重 CMV 感染成人病人,建議每 12 小時靜脈給予 5 mg/kg,其它病人可視情況調整 [61]。
- f. 於非晚期愛滋病毒感染病人中,由 CMV 單一病原造成之肺炎並不常見。患者具肺炎症狀、於肺部有 CMV 感染證據及排除其他肺部感染病原時建議治療 CMV 肺炎 [65]。若有其他肺炎病原時不建議治療 CMV。此外肺泡沖洗液培養或 PCR 檢測並非 CMV 肺炎之特異檢查 [66]。
- g. Ganciclovir 為建議首選,然而目前於愛滋病毒感染病人仍缺乏其於 CMV 肺炎之療效研究。Foscarnet 則考慮為另選,目前於愛滋病毒感染病人之療效研究亦相當少。IVIG/CMV IVIG 於愛滋病毒感染病人之療效目前尚屬未知 [61][65][67]。
- h. 以生物標誌為依據之先發治療(pre-emptive)策略於造血幹細胞移植病人是有效的。圖 2.7.3. 展示於此治療情境下之治療策略之範例。然而,各移植中心應考量其 CMV PCR 檢測方式,依病人狀況、CMV 檢測結果訂定依據風險啟動之先發治療原則(risk-adapted policy)[60](2B)。
- i. 開始先發治療後,CMV 病毒量有時一開始會上升,不應視為抗藥。若先發治療兩週後血中 CMV 病毒量上升達 10 倍則需考慮抗藥與另選藥物 [60](2B)。
- j. 器官移植病人,CMV 預防與先發治療均為可行策略。對於器官移植病人的先發治療,目前仍無通用之病毒量標準,建議各移植中心應制定適合該中心病人之 CMV 檢測與啟動先發治療流程 [62](2B)。
- k. 造血幹細胞移植時,若患者為 CMV- 陰性通常以 CMV- 陰性捐贈者為優先 [60](2B)。若 CMV- 陰性病人將接受 CMV 陰性或未知 CMV 狀態捐贈者的造血幹細胞移植,移植前後之血液製品輸注應以給予 CMV- 陰性或是經過白血球過濾後之 血液製品為原則 [60][68][69](1B)。
- l. 器官移植時,CMV 的預防策略與療程需考量各種因素,例如不同捐贈者與接受移植病人之 CMV 血清狀態組合,以及移植器官種類等因素 [62][63]。
- m. 造血幹細胞移植病人發生 CMV 疾病後建議可接受次級預防,且仍需追蹤血中 CMV 狀態。
圖 2.7.3. 造血幹細胞移植病人 CMV 先發治療(preemptive therapy)擬定治療策略之決策原則。
(改編自Boeckh等發表於 Blood 2009;113:5711-9 之文獻)[64] 
2-7-4 健康照護相關肺炎之治療
加入書籤
重點提要
隨著人口老化及台灣特有的全民健康保險系統、長期照護機構的普及與醫療資源的頻繁使用,本治療指引仍保留健康照護相關肺炎的概念。這些病人通常具有多項抗藥性菌之危險因子,得到肺炎應考慮多重抗藥性菌株感染,同時也因多重系統疾病而有重度肺炎及高致死率。關於健康照護相關肺炎的經驗性治療,許多因素必須列入考量,例如多重抗藥性致病菌的危險因子、血液透析相關肺炎、非典型致病菌及吸入性肺炎感染的風險等等。至於已知病原菌的治療建議,則可參考社區型肺炎及院內型肺炎/呼吸器相關肺炎治療指引。
主編:盛望徽
副編:劉偉倫
健康照護相關肺炎是指肺炎病人有下列情況者稱之:在 90 天內曾在急性病院住院大於二天以上者、住在安養院或長期照護機構者、30 天內接受針劑抗生素、化學治療、傷口照護以及透析的病人 [70]。這些病人得到肺炎應考慮多重抗藥性菌 株感染。雖然 2016 年美國感染症醫學會(Infectious Diseases Society of America, IDSA)及美國胸腔學會(American Thoracic Society, ATS)公布的治療指引已經將健康照護相關肺炎的概念移除掉,他們認為健康照護相關肺炎應該被視為一個獨立的臨床的狀況,並且可將其囊括於社區型肺炎治療指引 [71]。然而,考量台灣特有的全民健康保險系統及長期照護機構的普及和醫療資源頻繁使用情形,特別將健康照護相關肺炎的概念保留於本治療指引。雖然有許多健康照護相關肺炎的評分模組能夠正確地辨識具有不良預後的個案,但是這些模組並不能精準的預測發生多重抗藥性菌株感染的風險。我們需要新的方式來避免不必要的廣效性抗生素使用,同時降低不恰當地使用經驗性抗生素來治療多重抗藥性菌株感染的情況。本章節將討論下列相關議題:第一、多重抗藥性致病菌在健康照護相關肺炎的危險因子。第二、台灣健康照護相關肺炎的微生物學特性。第三、血液透析相關肺炎(Hemodialysis-associated pneumonia, HDAP)。第四、安養中心相關肺炎(Nursing home-acquired pneumonia, NHAP)。
一、多重抗藥性致病菌在健康照護相關肺炎的危險因子
因為口咽和肺微生物對抗生素有選擇性壓力,導致使用過抗生素有利於出現抗藥性病原體和感染 [72]。病人所接觸的抗生素類別可能會影響產生抗甲氧苯青黴素敏感金黃色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)的風險 [73]。抗生素暴露與多重抗藥性菌種風險增加之間也存在時間上的關係 [74]。其他危險因子由於改變了宿主生理機能,如存在於口咽部的微生物,常常與多重抗藥性菌種侵入下呼吸道有關。這些因素包括年齡,嗆入的風險,認知障礙,神經系統疾病,日常活動功能狀態差,慢性肺病,胃酸抑制和免疫抑制。總體而言,多重抗藥性菌種對於大多數風險因素的獨立預測值較低。然而,多重抗藥性菌種引起的累積感染風險隨著多種危險因素的增加而增加 [75](表 2.7.4.1.)。
二、台灣健康照護相關肺炎微生物的流行病學資料
在過去關於健康照護相關肺炎的研究中,台灣本土的流行病學資料十分有限,Pseudomonas spp. 約佔所有病原體中的三分之一。在一個六家醫院的多中心研究,共收集了 444 受試者,來比較先前用於社區型肺炎嚴重程度評分的工具,在健康照護相關肺炎的使用性如何。研究中 Pseudomonas spp. 在 259 個病原體中(來自 204 人)佔了 32%(N=83)[76]。而來自上述多中心的另一研究,共收集了 713 位病人,Pseudomonas spp. 在 383 個病原體中,佔了 29%(N=112)[77]。此外,另一探查透析病人發生抗藥性肺炎的危險因子的研究,共納入 530 位健康照護相關肺炎的病人,其 Pseudomonas spp. 佔了 24.3%(N=129)[78]。至於 MRSA 的比例,和 Pseudomonas spp. 相比則少了一些。在上述三個研究中, MRSA 的比例分別為 8.5%、7.8% 及 7%,皆少於一成 [76][77][78]。
三、血液透析相關肺炎(HDAP)
末期腎臟病人接受血液透析常面臨相關的感染問題,其中包括肺炎 [79]。血液透析相關肺炎的死亡率比一般族群肺炎的死亡率高 [80]。然而,目前關於血液透析相關肺炎致病菌的微生物學特性及患者的臨床特徵資訊相當有限,截至目前為止,並沒有可信的預測因子可以推估哪些族群的血液透析相關肺炎是由抗藥性病菌感染的所造成。
過去一些研究曾報導抗藥性致病菌在血液透析族群中造成感染的風險 [78][81][82][83]。而在抗藥性致病菌中,又以 MRSA [84] 及 Pseudomonas aeruginosa 是造成血液透析族群感染最重要的致病菌。血液透析族群容易得到 MRSA 的移生並增加後續發生感染的風險 [85]。然而,MRSA 肺炎在血液透析族群的發生率在各個研究中並不一致。必須透過更進一步研究才能釐清 MRSA 在血液透析相關肺炎的風險。研究指出,只有在嚴重的血液透析相關肺炎才建議經驗性使用治療 MRSA 的藥物 [78][81]。
四、安養中心相關肺炎(NHAP)
IDSA 2005 年治療指引表示,有些健康照護相關肺炎病人雖然沒有住院,但因常常進出醫療院所,或因住在慢性照護機構,故使該些病人感染抗藥性菌之風險有上升之可能 [70]。但 2016 年版 IDSA 則表示,這些健康照護相關肺炎病人感染抗藥性菌之風險,主要是與病人原本之身體狀況,或其於短時間內是否曾住院有關;至於病人治療結果及死亡率,則是與病人原本之身體狀況與身體固有之系統性疾病有關,而與是否曾感染抗藥性菌無明顯相關。
台灣長期照護機構住民中,有些只是單純因衰老需照顧而居住於機構內,但有些卻是長期臥病在床,且需依賴長期管路維持生理機能,故可知機構內之住民身體狀況差異甚大,從而各病人罹患肺炎之原因並不相同,因此本文將安養中心肺炎獨立討論。
2014 年有韓國論文指出,雖然發生安養中心相關肺炎之病人,其受抗藥性菌感染之比例、死亡率及住院天數,都比一般社區型肺炎病人高;但倘依照 PSI 或 CURB-65 分數為分析依據,肺炎病人之死亡率與其是否罹患安養中心相關肺炎或社區型肺炎無關,反而與初始感染肺炎之嚴重程度有關。又經比較安養中心相關肺炎與社區型肺炎之病人,此兩類病人對於抗藥性菌及綠膿桿菌(Pseudomonas)之感染比率,並無特別顯著差異 [86]。
此外,2015 年有文獻綜述表示,不應將安養中心相關肺炎當作院內型肺炎治療,因為這類病人感染抗藥性菌之比例較院內型肺炎低,但因該二類病人於罹病時身體條件差異之故,從而安養中心相關肺炎病人之死亡率較社區型肺炎病人高,故於臨床診治上,應根據病人罹病前之身體條件作為經驗性抗生素治療之考量因素 [87]。
安養中心相關肺炎病人因抗藥性比例較院內型肺炎病人低,因此臨床上就抗生素施用之選擇時,無治療院內型肺炎病人時需考慮抗藥性菌之問題,其治療重點應係考量各地區抗藥性比例。另因長照機構內之病人族群本身之多重共病及原本身體條件,故安養中心相關肺炎病人之死亡率及住院天數皆較社區型肺炎病人高,因此臨床上對於安養中心相關肺炎病人,除適當抗生素之選用外,控制其原本之潛在疾病更是肺炎治療中需要注意之事項。
五、健康照護相關肺炎的治療
表 2.7.4.2.摘錄多重抗藥性致病菌之分類與抗微生物製劑治療建議。有關已知病原菌的治療建議,請參考社區型肺炎及院內型肺炎/呼吸器相關肺炎治療指引。關於健康照護相關肺炎的經驗性治療,有許多因素必須列入考量,例如多重抗藥性致病菌的危險因子、血液透析相關肺炎、非典型致病菌及吸入性肺炎感染的風險等等。相關治療建議請參閱下表 。
表 2.7.4.1 健康照護相關肺炎的定義、多重抗藥性菌株感染之危險因子

表 2.7.4.2 健康照護相關肺炎之分類與抗微生物製劑治療建議

參考文獻
Garin N, Genne D, Carballo S, et al. Beta-lactam monotherapy vs beta-lactam-macrolide combination treatment in moderately severe community-acquired pneumonia: a randomized noninferiority trial. JAMA Intern Med 2014;174(12):1894-901. ↩︎ ↩︎
Postma DF, Van Werkhoven CH, Van Elden LJ, et al. Antibiotic treatment strategies for community-acquired pneumonia in adults. N Engl J Med 2015;372(14):1312-23. ↩︎ ↩︎
Horita N, Otsuka T, Haranaga S, et al. Beta-lactam plus macrolides or beta-lactam alone for community-acquired pneumonia: A systematic review and meta-analysis. Respirology 2016;21(7):1193-200. ↩︎ ↩︎
Vardakas KZ, Trigkidis KK, Falagas ME. Fluoroquinolones or macrolides in combination with beta-lactams in adult patients hospitalized with community acquired pneumonia: a systematic review and meta-analysis. Clin Microbiol Infect 2017;23(4):234-41. ↩︎ ↩︎
Lee JH, Kim HJ, Kim YH. Is beta-Lactam Plus Macrolide More Effective than beta-Lactam Plus Fluoroquinolone among Patients with Severe Community-Acquired Pneumonia?: a Systemic Review and Meta-Analysis. J Korean Med Sci 2017;32(1):77-84. ↩︎ ↩︎
Li JZ, Winston LG, Moore DH, et al. Efficacy of short-course antibiotic regimens for community-acquired pneumonia: a meta-analysis. Am J Med 2007;120(9):783-90. ↩︎ ↩︎ ↩︎
Dimopoulos G, Matthaiou DK, Karageorgopoulos DE, et al. Short- versus long-course antibacterial therapy for community-acquired pneumonia : a meta-analysis. Drugs 2008;68(13):1841-54. ↩︎ ↩︎ ↩︎
Uranga A, Espana PP, Bilbao A, et al. Duration of Antibiotic Treatment in Community-Acquired Pneumonia: A Multicenter Randomized Clinical Trial. JAMA Intern Med 2016;176(9):1257-65. ↩︎ ↩︎ ↩︎ ↩︎
Choudhury G, Mandal P, Singanayagam A, et al. Seven-day antibiotic courses have similar efficacy to prolonged courses in severe community-acquired pneumonia--a propensity-adjusted analysis. Clin Microbiol Infect 2011;17(12):1852-8. ↩︎ ↩︎
Mandell LA, Wunderink RG, Anzueto A, et al. Infectious Diseases Society of America/American Thoracic Society consensus guidelines on the management of community-acquired pneumonia in adults. Clin Infect Dis 2007;44(Suppl 2):S27-72. ↩︎ ↩︎
Athanassa Z, Makris G, Dimopoulos G, et al. Early switch to oral treatment in patients with moderate to severe community-acquired pneumonia: a meta-analysis. Drugs 2008;68(17):2469-81. ↩︎ ↩︎ ↩︎
Chen TC, Lu PL, Lin CY, et al. Fluoroquinolones are associated with delayed treatment and resistance in tuberculosis: a systematic review and meta-analysis. Int J Infect Dis 2011;15(3):e211-6. ↩︎ ↩︎ ↩︎ ↩︎
Migliori GB, Langendam MW, D'ambrosio L, et al. Protecting the tuberculosis drug pipeline: stating the case for the rational use of fluoroquinolones. Eur Respir J 2012;40(4):814-22. ↩︎ ↩︎ ↩︎
Raz-Pasteur A, Shasha D, Paul M. Fluoroquinolones or macrolides alone versus combined with beta-lactams for adults with community-acquired pneumonia: Systematic review and meta-analysis. Int J Antimicrob Agents 2015;46(3):242-8. ↩︎
Forstner C, Rohde G, Rupp J, et al. Community-acquired Haemophilus influenzae pneumonia--New insights from the CAPNETZ study. J Infect 2016;72(5):554-63. ↩︎
Kuo SC, Chen PC, Shiau YR, et al. Levofloxacin-resistant Haemophilus influenzae, Taiwan, 2004-2010. Emerg Infect Dis 2014;20(8):1386-90. ↩︎
Lau YJ, Hsueh PR, Liu YC, et al. Comparison of in vitro activities of tigecycline with other antimicrobial agents against Streptococcus pneumoniae, Haemophilus influenzae, and Moraxella catarrhalis in Taiwan. Microb Drug Resist 2006;12(2):130-5. ↩︎
Hsu SF, Lin YT, Chen TL, et al. Antimicrobial resistance of Moraxella catarrhalis isolates in Taiwan. J Microbiol Immunol Infect 2012;45(2):134-40. ↩︎
Ortiz-Ruiz G, Vetter N, Isaacs R, et al. Ertapenem versus ceftriaxone for the treatment of community-acquired pneumonia in adults: combined analysis of two multicentre randomized, double-blind studies. J Antimicrob Chemother 2004;53(Suppl 2):ii59-66. ↩︎
Yakovlev SV, Stratchounski LS, Woods GL, et al. Ertapenem versus cefepime for initial empirical treatment of pneumonia acquired in skilled-care facilities or in hospitals outside the intensive care unit. Eur J Clin Microbiol Infect Dis 2006;25(10):633-41. ↩︎
Laserna E, Sibila O, Fernandez JF, et al. Impact of macrolide therapy in patients hospitalized with Pseudomonas aeruginosa community-acquired pneumonia. Chest 2014;145(5):1114-20. ↩︎
Cheng AC, Fisher DA, Anstey NM, et al. Outcomes of patients with melioidosis treated with meropenem. Antimicrob Agents Chemother 2004;48(5):1763-5. ↩︎
Chetchotisakd P, Chierakul W, Chaowagul W, et al. Trimethoprim-sulfamethoxazole versus trimethoprim-sulfamethoxazole plus doxycycline as oral eradicative treatment for melioidosis (MERTH): a multicentre, double-blind, non-inferiority, randomised controlled trial. Lancet 2014;383(9919):807-14. ↩︎
Fogarty CM, Greenberg RN, Dunbar L, et al. Effectiveness of levofloxacin for adult community-acquired pneumonia caused by macrolide-resistant Streptococcus pneumoniae: integrated results from four open-label, multicenter, phase III clinical trials. Clin Ther 2001;23(3):425-39. ↩︎
Baddour LM, Yu VL, Klugman KP, et al. Combination antibiotic therapy lowers mortality among severely ill patients with pneumococcal bacteremia. Am J Respir Crit Care Med 2004;170(4):440-4. ↩︎
Wang Y, Zou Y, Xie J, et al. Linezolid versus vancomycin for the treatment of suspected methicillin-resistant Staphylococcus aureus nosocomial pneumonia: a systematic review employing meta-analysis. Eur J Clin Pharmacol 2015;71(1):107-15. ↩︎
Zhao F, Lv M, Tao X, et al. Antibiotic sensitivity of 40 Mycoplasma pneumoniae isolates and molecular analysis of macrolide-resistant isolates from Beijing, China. Antimicrob Agents Chemother 2012;56(2):1108-9. ↩︎
Burdet C, Lepeule R, Duval X, et al. Quinolones versus macrolides in the treatment of legionellosis: a systematic review and meta-analysis. J Antimicrob Chemother 2014;69(9):2354-60. ↩︎
Kung HC, Huang PY, Chen WT, et al. 2016 guidelines for the use of antifungal agents in patients with invasive fungal diseases in Taiwan. J Microbiol Immunol Infect 2017;51(1):1-17. ↩︎
Huang YT, Liao CH, Teng LJ, et al. Comparative bactericidal activities of daptomycin, glycopeptides, linezolid and tigecycline against blood isolates of Gram-positive bacteria in Taiwan. Clin Microbiol Infect 2008;14(2):124-9. ↩︎
Louie JK, Yang S, Acosta M, et al. Treatment with neuraminidase inhibitors for critically ill patients with influenza A (H1N1)pdm09. Clin Infect Dis 2012;55(9):1198-204. ↩︎
Dobson J, Whitley RJ, Pocock S, et al. Oseltamivir treatment for influenza in adults: a meta-analysis of randomised controlled trials. Lancet 2015;385(9979):1729-37. ↩︎
Jefferson T, Jones M, Doshi P, et al. Oseltamivir for influenza in adults and children: systematic review of clinical study reports and summary of regulatory comments. BMJ 2014;348:g2545. ↩︎
Kohno S, Kida H, Mizuguchi M, et al. Intravenous peramivir for treatment of influenza A and B virus infection in high-risk patients. Antimicrob Agents Chemother 2011;55(6):2803-12. ↩︎
De Jong MD, Ison MG, Monto AS, et al. Evaluation of intravenous peramivir for treatment of influenza in hospitalized patients. Clin Infect Dis 2014;59(12):e172-85. ↩︎
Ison MG, Fraiz J, Heller B, et al. Intravenous peramivir for treatment of influenza in hospitalized patients. Antivir Ther 2014;19(4):349-61. ↩︎
Chairat K, Jittamala P, Hanpithakpong W, et al. Population pharmacokinetics of oseltamivir and oseltamivir carboxylate in obese and non-obese volunteers. Br J Clin Pharmacol 2016;81(6):1103-12. ↩︎
Lemaitre F, Luyt CE, Roullet-Renoleau F, et al. Impact of extracorporeal membrane oxygenation and continuous venovenous hemodiafiltration on the pharmacokinetics of oseltamivir carboxylate in critically ill patients with pandemic (H1N1) influenza. Ther Drug Monit 2012;34(2):171-5. ↩︎
W.H.O. WHO Guidelines for Pharmacological Management of Pandemic Influenza A(H1N1) 2009 and other Influenza Viruses ed. Placed Published: World Health Organization.2010. ↩︎
South East Asia Infectious Disease Clinical Research Network. Effect of double dose oseltamivir on clinical and virological outcomes in children and adults admitted to hospital with severe influenza: double blind randomised controlled trial. BMJ 2013;346:f3039. ↩︎
Yeh KM, Siu LK, Chang JC, et al. Vancomycin-resistant enterococcus (VRE) carriage and infection in intensive care units. Microb Drug Resist 2004;10(2):177-83. ↩︎ ↩︎
Yale SH, Limper AH. Pneumocystis carinii pneumonia in patients without acquired immunodeficiency syndrome: associated illness and prior corticosteroid therapy. Mayo Clin Proc 1996;71(1):5-13. ↩︎ ↩︎
Yang JJ, Huang CH, Liu CE, et al. Multicenter study of trimethoprim/sulfamethoxazole-related hepatotoxicity: incidence and associated factors among HIV-infected patients treated for Pneumocystis jirovecii pneumonia. PLoS One 2014;9(9):e106141. ↩︎
Lee KY, Huang CH, Tang HJ, et al. Acute psychosis related to use of trimethoprim/sulfamethoxazole in the treatment of HIV-infected patients with Pneumocystis jirovecii pneumonia: a multicentre, retrospective study. J Antimicrob Chemother 2012;67(11):2749-54. ↩︎
Huang YS, Yang JJ, Lee NY, et al. Treatment of Pneumocystis jirovecii pneumonia in HIV-infected patients: a review. Expert Rev Anti Infect Ther 2017;15(9):873-92. ↩︎
Sun HY, Cheng A, Huang SH, et al. 2015. Anidulafungin for Patients with Pneumocystis carinii Pneumonia, an Alternative Option? In International Congress of Antimicrobial Chemotherapy (ICC)/Interscience Conference on Antimicrobial Agents and Chemotherapy (ICAAC). San Diego, USA. ↩︎
Kaplan JE, Hanson DL, Navin TR, et al. Risk factors for primary Pneumocystis carinii pneumonia in human immunodeficiency virus-infected adolescents and adults in the United States: reassessment of indications for chemoprophylaxis. J Infect Dis 1998;178(4):1126-32. ↩︎
Phair J, Munoz A, Detels R, et al. The risk of Pneumocystis carinii pneumonia among men infected with human immunodeficiency virus type 1. Multicenter AIDS Cohort Study Group. N Engl J Med 1990;322(3):161-5. ↩︎
Stern A, Green H, Paul M, et al. Prophylaxis for Pneumocystis pneumonia (PCP) in non-HIV immunocompromised patients. Cochrane Database Syst Rev 2014(10):CD005590. ↩︎
Sepkowitz KA, Brown AE, Armstrong D. Pneumocystis carinii pneumonia without acquired immunodeficiency syndrome. More patients, same risk. Arch Intern Med 1995;155(11):1125-8. ↩︎
Thomas CFJ, Limper AH. Pneumocystis pneumonia. N Engl J Med 2004;350(24):2487-98. ↩︎
Baden LR, Swaminathan S, Angarone M, et al. Prevention and Treatment of Cancer-Related Infections, Version 2.2016, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw 2016;14(7):882-913. ↩︎ ↩︎ ↩︎
Mikulska M, Lanini S, Gudiol C, et al. ESCMID Study Group for Infections in Compromised Hosts (ESGICH) Consensus Document on the safety of targeted and biological therapies: an infectious diseases perspective (agents targeting lymphoid cells surface antigens [I]: CD19, CD20 and CD52). Clin Microbiol Infect 2018;24(Suppl2):S71-82. ↩︎
Khan BA, Khan S, White B, et al. Severe pneumocystis jiroveci pneumonia in a patient on temozolomide therapy: A case report and review of literature. Respir Med Case Rep 2017;22:179-82. ↩︎
Tomblyn M, Chiller T, Einsele H, et al. Guidelines for preventing infectious complications among hematopoietic cell transplant recipients: a global perspective. Preface. Bone Marrow Transplant 2009;44(8):453-5. ↩︎ ↩︎
Martin SI, Fishman JA, A. S. T. Infectious Diseases Community of Practice. Pneumocystis pneumonia in solid organ transplantation. Am J Transplant 2013;13(Suppl 4):272-9. ↩︎
Thomas Cf J, Ah. L. Treatment and prevention of Pneumocystis pneumonia in HIV-uninfected patients. In: UpToDate;Post, TW (Ed), UpToDate, Waltham, MA, 2018. Feb 2018 ed; 2018. ↩︎
Mussini C, Pezzotti P, Antinori A, et al. Discontinuation of secondary prophylaxis for Pneumocystis carinii pneumonia in human immunodeficiency virus-infected patients: a randomized trial by the CIOP Study Group. Clin Infect Dis 2003;36(5):645-51. ↩︎
Lopez Bernaldo De Quiros JC, Miro JM, Pena JM, et al. A randomized trial of the discontinuation of primary and secondary prophylaxis against Pneumocystis carinii pneumonia after highly active antiretroviral therapy in patients with HIV infection. Grupo de Estudio del SIDA 04/98. N Engl J Med 2001;344(3):159-67. ↩︎
Emery V, Zuckerman M, Jackson G, et al. Management of cytomegalovirus infection in haemopoietic stem cell transplantation. Br J Haematol 2013;162(1):25-39. ↩︎ ↩︎ ↩︎ ↩︎ ↩︎
Ljungman P, De La Camara R, Cordonnier C, et al. Management of CMV, HHV-6, HHV-7 and Kaposi-sarcoma herpesvirus (HHV-8) infections in patients with hematological malignancies and after SCT. Bone Marrow Transplant 2008;42(4):227-40. ↩︎ ↩︎ ↩︎
Kotton CN, Kumar D, Caliendo AM, et al. Updated international consensus guidelines on the management of cytomegalovirus in solid-organ transplantation. Transplantation 2013;96(4):333-60. ↩︎ ↩︎ ↩︎ ↩︎
Razonable RR, Humar A, A. S. T. Infectious Diseases Community of Practice. Cytomegalovirus in solid organ transplantation. Am J Transplant 2013;13 Suppl 4:93-106. ↩︎ ↩︎
Boeckh M, Ljungman P. How we treat cytomegalovirus in hematopoietic cell transplant recipients. Blood 2009;113(23):5711-9. ↩︎ ↩︎
Pokorska-Spiewak M, Niezgoda A, Golkowska M, et al. Recommendations for the diagnosis and treatment of CMV infections. Polish Society of Epidemiology and Infectious Diseases. Przegl Epidemiol 2016;70(2):297-310. ↩︎ ↩︎
Miles PR, Baughman RP, Linnemann CC, Jr. Cytomegalovirus in the bronchoalveolar lavage fluid of patients with AIDS. Chest 1990;97(5):1072-6. ↩︎
Shelhamer JH. Cytomegalovirus infection as a cause of pulmonary disease in HIV-infected patients.: Accessed Jan 29, 2018. ↩︎
Ullmann AJ, Schmidt-Hieber M, Bertz H, et al. Infectious diseases in allogeneic haematopoietic stem cell transplantation: prevention and prophylaxis strategy guidelines 2016. Ann Hematol 2016;95(9):1435-55. ↩︎
Marty FM, Ljungman P, Chemaly RF, et al. Letermovir Prophylaxis for Cytomegalovirus in Hematopoietic-Cell Transplantation. N Engl J Med 2017;377(25):2433-44. ↩︎
American Thoracic Society, Infectious Diseases Society of America. Guidelines for the management of adults with hospital-acquired, ventilator-associated, and healthcare-associated pneumonia. Am J Respir Crit Care Med 2005;171(4):388-416. ↩︎ ↩︎
Kalil AC, Metersky ML, Klompas M, et al. Management of Adults With Hospital-acquired and Ventilator-associated Pneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clin Infect Dis 2016;63(5):e61-e111. ↩︎
Costelloe C, Metcalfe C, Lovering A, et al. Effect of antibiotic prescribing in primary care on antimicrobial resistance in individual patients: systematic review and meta-analysis. BMJ 2010;340:c2096. ↩︎
Metersky ML, Frei CR, Mortensen EM. Predictors of Pseudomonas and methicillin-resistant Staphylococcus aureus in hospitalized patients with healthcare-associated pneumonia. Respirology 2016;21(1):157-63. ↩︎
Kuster SP, Rudnick W, Shigayeva A, et al. Previous antibiotic exposure and antimicrobial resistance in invasive pneumococcal disease: results from prospective surveillance. Clin Infect Dis 2014;59(7):944-52. ↩︎
Webb BJ, Dangerfield BS, Pasha JS, et al. Guideline-concordant antibiotic therapy and clinical outcomes in healthcare-associated pneumonia. Respir Med 2012;106(11):1606-12. ↩︎
Fang WF, Yang KY, Wu CL, et al. Application and comparison of scoring indices to predict outcomes in patients with healthcare-associated pneumonia. Critical Care 2011;15(1):R32. ↩︎ ↩︎
Wu CL, Ku SC, Yang KY, et al. Antimicrobial drug-resistant microbes associated with hospitalized community-acquired and healthcare-associated pneumonia: a multi-center study in Taiwan. J Formos Med Assoc 2013;112(1):31-40. ↩︎ ↩︎
Wang PH, Wang HC. Risk factors to predict drug-resistant pathogens in hemodialysis-associated pneumonia. BMC Infect Dis 2016;16:377. ↩︎ ↩︎ ↩︎ ↩︎
Berman SJ, Johnson EW, Nakatsu C, et al. Burden of infection in patients with end-stage renal disease requiring long-term dialysis. Clin Infect Dis 2004;39(12):1747-53. ↩︎
Slinin Y, Foley RN, Collins AJ. Clinical epidemiology of pneumonia in hemodialysis patients: the USRDS waves 1, 3, and 4 study. Kidney Int 2006;70(6):1135-41. ↩︎
Song JU, Park HK, Kang HK, et al. Proposed risk factors for infection with multidrug-resistant pathogens in hemodialysis patients hospitalized with pneumonia. BMC Infect Dis 2017;17(1):681. ↩︎ ↩︎
Lee JH, Moon JC. Clinical characteristics of patients with hemodialysis-associated pneumonia compared to patients with non-hemodialysis community-onset pneumonia. Respir Med 2016;111:84-90. ↩︎
Kawasaki S, Aoki N, Kikuchi H, et al. Clinical and microbiological evaluation of hemodialysis-associated pneumonia (HDAP): should HDAP be included in healthcare-associated pneumonia? J Infect Chemother 2011;17(5):640-5. ↩︎
Self WH, Wunderink RG, Williams DJ, et al. Staphylococcus aureus Community-acquired Pneumonia: Prevalence, Clinical Characteristics, and Outcomes. Clin Infect Dis 2016;63(3):300-9. ↩︎
Zacharioudakis IM, Zervou FN, Ziakas PD, et al. Meta-analysis of methicillin-resistant Staphylococcus aureus colonization and risk of infection in dialysis patients. J Am Soc Nephrol 2014;25(9):2131-41. ↩︎
Dhawan N, Pandya N, Khalili M, et al. Predictors of mortality for nursing home-acquired pneumonia: a systematic review. Biomed Res Int 2015;2015:285983. ↩︎
Lim CW, Choi Y, An CH, et al. Facility characteristics as independent prognostic factors of nursing home-acquired pneumonia. Korean J Intern Med 2016;31(2):296-304. ↩︎