第二章:社區型肺炎
2-3 診斷措施(一): 臨床、放射線、血液、尿液檢查
重點提要
社區型肺炎的嚴重性評估,除臨床症狀外,可使用肺炎嚴重度指數(Pneumonia Severity Index(PSI))以及 CURB-65,作為病人醫療處置及預後評估參考。胸部 X 光檢查是建立肺炎診斷的黃金標準,需要住院治療之社區型肺炎及所有院內型肺炎病人宜例行作血液培養。血清學檢查僅適用於某些不易培養之致病菌之輔助診斷,分子生物學檢驗無法分辨是移生或是致病菌,建議用下呼吸道的檢體檢驗。CRP 在鑑別社區型肺炎的嚴重度及病原菌種類為典型或非典型時,其預測效果不一,儘管 PCT 較低可能暗示肺炎為病毒感染機率較高,但仍需配合臨床狀況謹慎評估。尿液抗原檢測可協助診斷肺炎 鏈球菌或退伍軍人桿菌所引起之肺炎。
主編:古世基
副編:盛望徽
一、臨床嚴重度評估
加入書籤
(一)症狀及嚴重度評估
可因嚴重度而有不同的表現,典型的症狀包含發燒、咳嗽、膿痰帶有血絲,嚴重一點的病人可能呈現單側胸痛( 部分可能隨深呼吸而加劇)以及呼吸困難;而一些非典型的細菌引起的肺炎可以是全身性症狀包含乾咳、鼻塞、喉嚨痛、頭痛、發燒、腹瀉、噁心、嘔吐等等。診斷主要的依據為肺炎症狀加上影像有肺部實質化或是浸潤表現 [1]。
臨床上評估肺炎嚴重度在社區型肺炎比較著名的指標包含肺炎嚴重度指數 Pneumonia Severity Index, PSI[2] 以 及 CURB-65 [3],部分研究顯示 PSI 相較於 CURB-65 對於低風險的肺炎有比較好的預測率 [4],但其評估方式相對複雜耗時,需分成兩個步驟,第一個步驟先看危險因子,第二步驟再從危險因子加上臨床表現來做評分分類。CURB-65 相對簡單(見表 2.3.1),只需要看病人是否有下列危險因子:意識不清、尿素氮 > 20mg/dL、呼吸速率每分鐘 ≥ 30 次、血壓是否太低(收縮壓 < 90 mmHg或舒張壓 ≤ 60 mmHg)以及年紀是否≥ 65歲。通常 0 或 1 個危險因子是輕度肺炎,建議門診治療,2 或 3 個危險因子是中度肺炎, 一般建議住院觀察治療,4 個以上危險因子為重度肺炎,死亡率在部分研究甚至高達 40% 以上,另外為了方便門診病人使用(不用抽血),也有研究指出可以使用 CRB-65(少了尿素氮檢查),包含一項以上就建議住院治療 [5]。要提醒的是,臨床肺部感染指數(Clinical pulmonary infection score, CPIS)不適合使用在社區型肺炎嚴重的評估,主要是其研究對象幾乎都是呼吸器肺炎或是院內型肺炎病 人 [6],在社區型肺炎的病人使用幾乎是沒有相關的文獻。美國胸腔科醫學會(American Thoracic Society, ATS)也有針對嚴重的社區型肺炎作定義 [7],其主要的定義要至少符合兩個主要的標準其中一個或是三個次要標準其中兩個。主要標準包含需要使用呼吸器或是敗血性休克,次要包含標準收縮壓 ≤ 90 mm Hg,多個肺葉疾病,和 PaO2 / FiO2 比值 < 250。符合嚴重社區型肺炎定義病人建議要入住加護病房。
表 2.3.1 CURB65 診斷項目與嚴重度評估
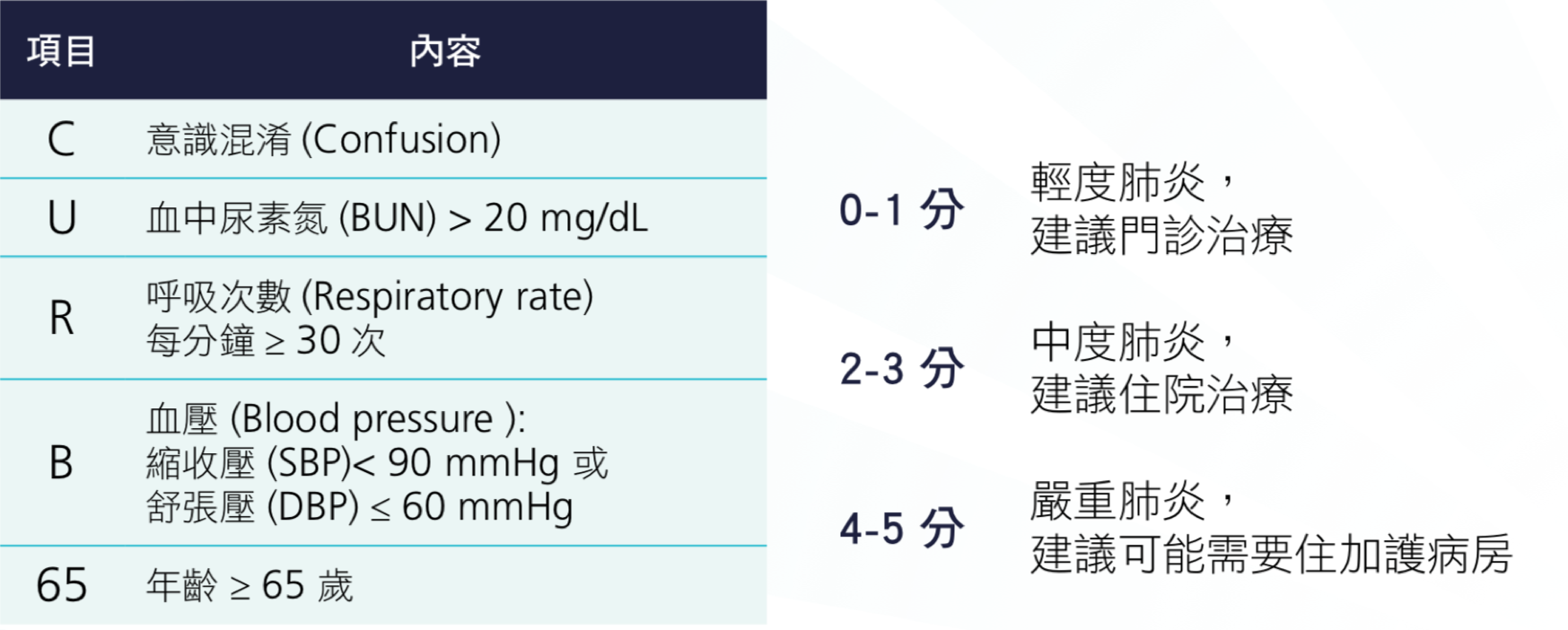 *以上每項目各1分
*以上每項目各1分
(二)本節重要臨床問題
| GRADE 建議等級 | 臨床建議內容 | 參考文獻 |
|---|---|---|
| 2B | 建議使用 CURB-65( 見表 2.3.1)來評估社區型肺炎的嚴重度。 | [3][4] |
二、放射線
加入書籤
(一)胸部 X 光檢查(CXR)
- 建立肺炎的診斷主要工具之一 [1][8][9]。
- 依照影像表現,可以猜測可能的致病原 [1][10][11]。
- 細菌:在 CXR 上常以大葉性實質化(lobar consolidation) 來表現,但一些非典型的細菌像是 Legionella spp.,Mycoplasma spp. 或是 Chlamydophila spp. 較常以雙側肺部浸潤來表現。
- 病毒:較常以雙側肺部浸潤來表現。
- 黴菌:在胸部 X 光較難直接診斷,如病人有危險因子可考慮進行電腦斷層檢查。
- 肺結核:初次感染跟再復發影響的肺葉較不同,胸部 X 光常可看到濃淡不均且邊緣不清楚的肺實質變化,也可能伴隨著淋巴結鈣化或是開洞病灶。
- 偵測併發症:如肋膜積液、膿胸,而有併發症產生會影響到後續治療,考慮引流甚至外科手術。
- 觀察對治療的反應。
(二)胸部電腦斷層(Chest computed tomography)
- 胸部電腦斷層相較於 CXR 可以增加肺炎的偵測 [12],也可以減少不必要的治療 [13],但由於價錢、可及性(accessibility)以及輻射量的考量,並非懷疑社區型肺炎的常規檢查。
- 特定的微生物造成的肺炎具特徵性的影像變化( 如:Aspergillus, M. tuberculosis, and Pneumocystis),可以在還沒有侵襲性檢查或微生物培養前提早診斷並盡早使用藥物治療。
- 對於免疫功能不全或是老年人來說,胸部電腦斷層在於治療以及預後有較重要的角色 [14][15]。
(三)本節重要臨床問題
| GRADE 建議等級 | 臨床建議內容 | 參考文獻 |
|---|---|---|
| 1C | 胸部 X 光檢查是建立肺炎診斷時最重要的檢查。 | [1][8][9] |
| 2C | 在無法確定肺炎診斷時或是病人有免疫不全危險因子可以考慮胸部電腦斷層檢查。 | [12][14][15] |
三、血液學檢查( 血液培養、血清學檢查、分子生物學檢驗、生物指標)
加入書籤
(一)血液培養
血液培養儘量取兩處以上不同部位血管之血液檢體進行檢查。
- 優點:血液檢體容易取得、操作簡單、便宜、特異性高。血液培養具診斷與評估預後之臨床價值,雖然 < 20% 的肺炎可經由血液培養檢查確定診斷,但可提供預後評估的參考;血液培養呈陽性患者屬高危險群,常併發其他部位之感染。建議需要住院治療之社區型肺炎及所有院內型肺炎病人宜例行作血液培養。並應注意肺炎鏈球菌和其他革蘭氏陽性菌可能在厭氧的血瓶中生長狀況最好。血液培養最重要的關鍵點是每套血量需 10cc,不是抽血時間。
- 缺點:靈敏度低。
(二)血清學檢查
- 優點:血液檢體容易取得,可提供有關流行病學資料。
- 缺點:靈敏度低與特異度不高,需取急性期及恢復期之血清檢體進行檢查,無法在肺炎初期確定診斷,臨床價值不高。僅適用於某些不易培養之致病菌,如 Mycoplasma pneumoniae(1~33%)、Legionella pneumophila(0~13%)及 Chlamydophila pneumoniae(7~37%),和 Bordetella pertussis。例如,在 19 歲以上的肺炎感染者以 M. pneumoniae 免疫球蛋白 M 抗體(IgM)檢驗,其靈敏度和特異性分別為 40% 和 82%。
- 此外,常被分離出的病毒病原菌,若可檢測配對急性期和恢復期的血清學檢查,對診斷亦有幫助,如呼吸道融合病毒和腺病毒 [16]。
- 在嚴重(如侵襲性肺炎鏈球菌感染症)和罕見病原菌(如隱球菌或肺囊蟲肺炎) 造成之社區型肺炎,建議做人類免疫缺乏病毒(human immunodeficiency, HIV)篩檢 [17]。
(三)分子生物學檢驗
- 優點:適用於某些不易培養或生長緩慢之致病菌,如 Mycobacterium, Mycoplasma, Chlamydophila species, Bordetella 及 Pneumocystis jirovecii。目前除耐酸性染色呈陽性之分枝桿菌和 influenza, adenovirus 可使用聚合酶連鎖反應(Polymerase chain reaction, PCR)外,不建議例行使用 [18]。
- 缺點:無法分辨是移生(colonization)或是污染(contamination),需要特別 的技術和設備。若要降低偽陽性和偽陰性的機率,建議用下呼吸道的檢體(如透過支氣管肺泡灌洗術 BAL 收集檢體) 。在群突發的狀況下,聚合酶連鎖反應是個不錯的工具,主要是因其較敏感,低菌量的狀況下仍能偵測到。
(四)生物標記
- C- 反應蛋白(C-reactive protein, CRP)
CRP 主要由肝細胞製造,調控補體系統與促進發炎反應,在發炎或組織受損等原因刺激後約 6 小時釋出,約 48 小時達最高值 [19]。CRP 受眾多干擾因素影響,敏感性高但特異性低,故多被視為非特異性發炎反應的生物標記 [20]。CRP 因檢驗成本相較其他發炎相關生物標記低,而較常被使用。在判斷病人是否感染社區型肺炎與是否投以抗生素治療時,CRP 高只能視為輔助臨床判斷工具之一,而非診斷肺炎之單一標準; CRP 低且肝細胞製造功能無異常者,仍應謹慎評估病人臨床狀況是否需要抗生素治療 [21]。在鑑別社區型肺炎的嚴重度及病原菌種類為典型或非典型時,CRP 的預測效果不一 [22][23][24][25][26]。 - 前降鈣素(procalcitonin, PCT)
前降鈣素(PCT)是降鈣素的前驅產物,作為內分泌賀爾蒙,由甲狀腺 C 細胞與肺部 K 細胞分泌;同時具有細胞激素之功能,當器官如肝、腎等,受外來微生物毒素或促發炎因子刺激後,約 2~4 小時便會釋放,因釋放速度不一,臨床應用可考慮於不同時間點量測以比較變化趨勢 [18][20][27]。在判斷病人是否投以抗生素治療時,使用 PCT 輔助決策組較對照組 之 30 天死亡率低(8.6% 及 10.0%,校正後勝算比(adjusted odds ratio, OR)0.83, 95% 信賴區間(confidence interval, CI): 0.70 to 0.99, P = 0.037),治療失敗率無差異(23.0% 及 24.9%),抗生素使用效期縮短約 2.4 天(5.7 及 8.1 天,95% CI: -2.71 ∼ -2.15, P < 0.001),且抗生素相關副作用較低。PCT 可輔助臨床判斷,作為社區型肺炎啟用、調整或停用抗生素時之重要參考依據 [28][29][30]。在鑑別社區型肺炎的嚴重度,將 PCT 合併臨床風險評估指標如 CURB-65 等,比起單一評估指標更能鑑別社區型肺炎的嚴重度 [28][29]。在鑑別社區型肺炎的病原菌種類,PCT 預測效果不一。儘管 PCT 較低可能暗示肺炎為病毒感染機率較高,但仍需配合臨床狀況謹慎評估 [25][26][31]。 - 前腎上腺髓質素(proadrenomedullin, pro-ADM)
腎上腺髓質素(adrenomedullin, ADM)與 PCT 來自相同基因,ADM 能使血管擴張,且具調節免疫與代謝之功能,進而對抗細菌 [32]。由於 ADM 半衰期很短,故應用上會以較穩定的前腎上腺髓質素(pro-ADM)作為測量標的。已知 pro-ADM 在敗血症患者濃度會上升 [33]。在鑑別社區型肺炎的嚴重度時,pro-ADM 濃度上升與患者死亡率上升及肺炎相關併發症增加成正相關 [26][34][35]。將 pro-ADM 合併臨床風險評估指標如 CURB-65 等,比起單一評估指標更能鑑別社區型肺炎的嚴重度 [34][35]。
(五)本節重要臨床問題
| GRADE 建議等級 | 臨床建議內容 | 參考文獻 |
|---|---|---|
| 1C | 對輕微至中等程度的社區型肺炎(定義為門診病人),並不建議常規做血液培養檢查。 | [1][8][9] |
| 1C | 對嚴重程度的社區型肺炎(定義為需住院,或發生在免疫不全患者),考慮血液培養合併適當的痰液培養。 | [18][36][37] |
| 1C | 黴菌和分枝桿菌的血液培養合併適當的痰液培養,考慮用於高危險族群的免疫不全病人(如愛滋病毒感染者,器官移植患者或罹患血液腫瘤的病人)。 | [38][39] |
| 1B | 為使血液培養結果最佳化,建議在使用經驗性抗生素前先做,兩套血液培養要從不同部位抽取(每套同時包括嗜氧和厭氧共兩瓶),每套血量需 10mL。 | [36] |
| 1B | 在評估社區型肺炎病人病情嚴重度與治療反應時,生物標記可作為輔助臨床病況與影像檢查之參考工具。 | [20][28][40] |
| 1B | 在判斷社區型肺炎病人是否需投以抗生素治療時,前降鈣激素(PCT) 可輔助臨床病況與影像檢查,作為抗生素管理使用之參考依據。 | [28][30] |
四、尿液抗原檢驗
加入書籤
尿液抗原檢測:可協助診斷肺炎鏈球菌或退伍軍人桿菌所引起之肺炎。
(一)肺炎鏈球菌肺炎
尿液抗原檢測之敏感性約 52%~78%,尤其在病情較為嚴重者,如合併菌血症其敏感性更高,約 80%~85%;特異性大於 90% [36][41]。優點為檢查快速(約 15 分鐘)、簡單、特異性高,且在病人接受抗生素治療後仍有機會診斷病因 [42]。缺點為價格高昂、無法得知細菌對抗生素之藥物敏感性、少部分口腔內鏈球菌(S. mitis and S. oralis)會導致偽陽性,前次感染後 4 到 6 週仍可維持 40%~70% 陽性率 [43]。前述尿液抗原檢測方法,是針對肺炎鏈球菌的 C 端多醣體採用免疫色層分析膜進行檢驗(BinaxNow® assay),然而 C 端多醣體在肺炎鏈球菌不同血清型上皆有,故篩檢陽性亦無法得知肺炎鏈球菌的血清分型。Luminex® 為新型態檢驗方式,透過多抗原接合(multiple antigen-binding assay),可偵測細菌套膜上的多醣體,進而區分出 13 種不同血清型的肺炎鏈球菌;此外,即使病人病情較輕,其敏感度仍高達 97.1%,特異性約 100% [44]。對於程度嚴重的社區型肺炎,建議進行肺炎鏈球菌之尿液抗原快速檢測。
(二)退伍軍人症肺炎
尿液抗原篩檢為檢測退伍軍人症之主要方法。感染退伍軍人桿菌後約 2 ~ 3 天可偵測到該抗原,敏感性約 56% ~ 99%,且會隨病人之病情嚴重度上升而增加。其中針對嗜肺性退伍軍人桿菌血清型第一型 mAb 3/1 敏感性約 80% ~ 90%, 非此特殊血清型則敏感性較低;特異性約 99% [45][46]。尿液抗原檢測優點為檢查快速(約 30 分鐘)、價格相對其他方法便宜、且在病人接受抗生素治療後仍有助於診斷病因。缺點為目前市售的檢測試劑只能檢測血清型第一型、前次感染後可維 持約 1 到 2 個月的陽性率、免疫功能低下患者之陽性率甚至可長達 10 個月以上 [47]。其他診斷退伍軍人症的方法,多為低敏感性,高特異性(見表 2.3.2)。其中細菌培養的敏感性雖受病人病情嚴重度而異,卻能避免尿液抗原僅能檢測血清型第一型之困境。而分子檢測(如 PCR:聚合脢連鎖反應)大多用於研究,臨床上或許可協助診斷較輕症之病人。一般針對退伍軍人症肺炎,建議同時進行痰液培養與尿液抗原檢測;但若已知所處環境中退伍軍人桿菌大多非血清型第一型,則建議同時進行培養與分子檢測。若所處醫療機構僅提供血清型第一型尿液抗原檢測,且病人臨床條件符合退伍軍人症表現,可考慮通報疾病管制署並採檢送驗。對於程度嚴重的社區型肺炎,建議進行退伍軍人桿菌之尿液抗原快速檢測。
表 2.3.2 退伍軍人症診斷方法
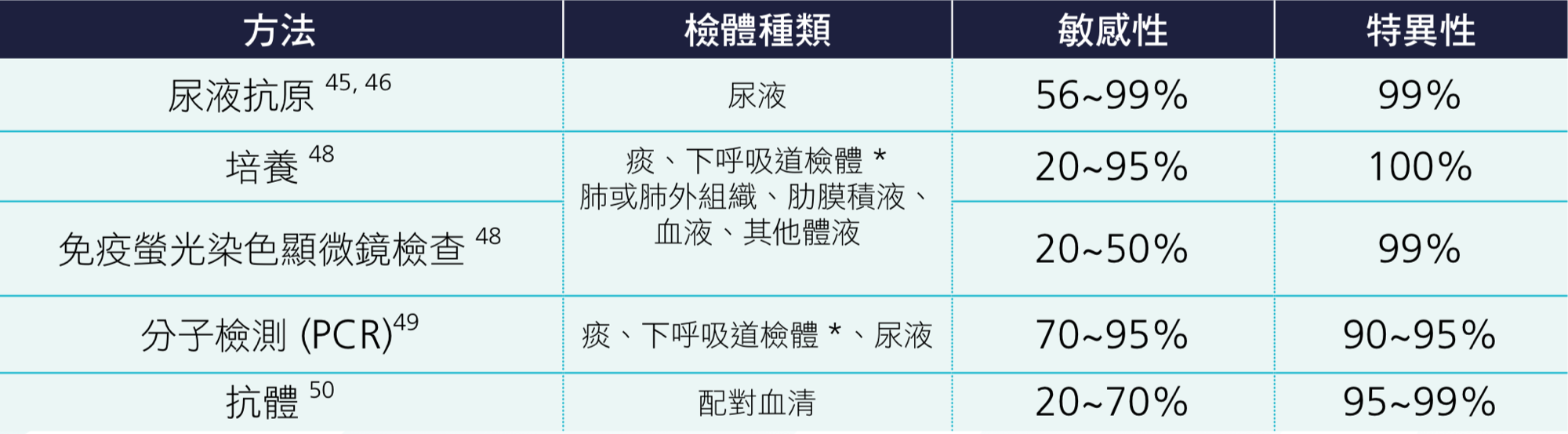 *下呼吸道檢體(如透過支氣管肺泡灌洗術收集之檢體)
PCR: polymerase chain reaction,聚合脢連鎖反應。
*下呼吸道檢體(如透過支氣管肺泡灌洗術收集之檢體)
PCR: polymerase chain reaction,聚合脢連鎖反應。
(三)本節重要臨床問題
| GRADE 建議等級 | 臨床建議內容 | 參考文獻 |
|---|---|---|
| 1B | 對於程度嚴重的社區型肺炎,建議進行肺炎鏈球菌及退伍軍人桿菌之尿液抗原快速檢測。 | [9][21][48] |
五、參考文獻
加入書籤
John E. Bennett RD, Martin J. Blaser. 2015. Mandell, Douglas, and Bennett’s Principles and Practice of Infectious Diseases. Springer. ↩︎ ↩︎ ↩︎ ↩︎ ↩︎
Fine MJ, Auble TE, Yealy DM, et al. A prediction rule to identify low-risk patients with community-acquired pneumonia. New Engl J Med 1997;336(4):243-50. ↩︎
Lim W, Van Der Eerden M, Laing R, et al. Defining community acquired pneumonia severity on presentation to hospital: an international derivation and validation study. Thorax 2003;58(5):377-82. ↩︎ ↩︎
Aujesky D, Auble TE, Yealy DM, et al. Prospective comparison of three validated prediction rules for prognosis in community-acquired pneumonia. Am J Med 2005;118(4):384-92. ↩︎ ↩︎
Bauer TT, Ewig S, Marre R, et al. CRB-65 predicts death from community-acquired pneumonia. J Intern Med 2006;260(1):93-101. ↩︎
Pugin J, Auckenthaler R, Mili N, et al. Diagnosis of ventilator-associated pneumonia by bacteriologic analysis of bronchoscopic and nonbronchoscopic “blind” bronchoalveolar lavage fluid. American Review of Respiratory Disease 1991;5 Pt 1(143):1121-9. ↩︎
Niederman MS, Mandell LA, Anzueto A, et al. Guidelines for the management of adults with community-acquired pneumonia. Diagnosis, assessment of severity, antimicrobial therapy, and prevention. Am J Respir Crit Care Med 2001;163(7):1730-54. ↩︎
Bartlett JG, Dowell SF, Mandell LA, et al. Practice guidelines for the management of community-acquired pneumonia in adults. Infectious Diseases Society of America. Clin Infect Dis 2000;31(2):347-82. ↩︎ ↩︎ ↩︎
Mandell LA, Wunderink RG, Anzueto A, et al. Infectious Diseases Society of America/American Thoracic Society consensus guidelines on the management of community-acquired pneumonia in adults. Clin Infect Dis 2007;44 (Suppl 2):S27-72. ↩︎ ↩︎ ↩︎ ↩︎
Boersma WG, Daniels JM, Lowenberg A, et al. Reliability of radiographic findings and the relation to etiologic agents in community-acquired pneumonia. Respir Med 2006;100(5):926-32. ↩︎
Kim EA, Lee KS, Primack SL, et al. Viral pneumonias in adults: radiologic and pathologic findings. Radiographics 2002;22 Spec No:S137-49. ↩︎
Syrjala H, Broas M, Suramo I, et al. High-resolution computed tomography for the diagnosis of community-acquired pneumonia. Clin Infect Dis 1998;27(2):358-63. ↩︎ ↩︎
Claessens YE, Debray MP, Tubach F, et al. Early Chest Computed Tomography Scan to Assist Diagnosis and Guide Treatment Decision for Suspected Community-acquired Pneumonia. Am J Respir Crit Care Med 2015;192(8):974-82. ↩︎
Nyamande K, Lalloo UG, Vawda F. Comparison of plain chest radiography and high-resolution CT in human immunodeficiency virus infected patients with community-acquired pneumonia: a sub-Saharan Africa study. Br J Radiol 2007;80(953):302-6. ↩︎ ↩︎
Haga T, Fukuoka M, Morita M, et al. Computed Tomography for the Diagnosis and Evaluation of the Severity of Community-acquired Pneumonia in the Elderly. Intern Med 2016;55(5):437-41. ↩︎ ↩︎
Johansson N, Kalin M, Tiveljung-Lindell A, et al. Etiology of community-acquired pneumonia: increased microbiological yield with new diagnostic methods. Clin Infect Dis 2010;50(2):202-9. ↩︎
Blasi F, Matteelli A. Indicator condition-guided HIV testing in Europe: a step forward to HIV control. Eur Respir J 2013;42(3):572-5. ↩︎
Woodhead M, Blasi F, Ewig S, et al. Guidelines for the management of adult lower respiratory tract infections--full version. Clin Microbiol Infect 2011;17 Suppl 6:E1-59. ↩︎ ↩︎ ↩︎
Hebecker M, Okemefuna AI, Perkins SJ, et al. Molecular basis of C-reactive protein binding and modulation of complement activation by factor H-related protein 4. Mol Immunol 2010;47(6):1347-55. ↩︎
Krüger S, Welte T. Biomarkers in community-acquired pneumonia. Expert Review of Respiratory Medicine 2012;6(2):203-14. ↩︎ ↩︎ ↩︎
National Clinical Guideline C. 2014. National Institute for Health and Care Excellence: Clinical Guidelines. In Pneumonia: Diagnosis and Management of Community- and Hospital-Acquired Pneumonia in Adults. London: National Institute for Health and Care Excellence (UK), National Clinical Guideline Centre, 2014. ↩︎ ↩︎
Hedlund J, Hansson LO. Procalcitonin and C-reactive protein levels in community-acquired pneumonia: correlation with etiology and prognosis. Infection 2000;28(2):68-73. ↩︎
Garcia Vazquez E, Martinez JA, Mensa J, et al. C-reactive protein levels in community-acquired pneumonia. Eur Respir J 2003;21(4):702-5. ↩︎
Hohenthal U, Hurme S, Helenius H, et al. Utility of C-reactive protein in assessing the disease severity and complications of community-acquired pneumonia. Clin Microbiol Infect 2009;15(11):1026-32. ↩︎
Kruger S, Ewig S, Papassotiriou J, et al. Inflammatory parameters predict etiologic patterns but do not allow for individual prediction of etiology in patients with CAP: results from the German competence network CAPNETZ. Respir Res 2009;10:65. ↩︎ ↩︎
Bello S, Lasierra AB, Minchole E, et al. Prognostic power of proadrenomedullin in community-acquired pneumonia is independent of aetiology. Eur Respir J 2012;39(5):1144-55. ↩︎ ↩︎ ↩︎
Morley D, Torres A, Cilloniz C, et al. Predictors of treatment failure and clinical stability in patients with community acquired pneumonia. Ann Transl Med 2017;5(22):443. ↩︎
P, Litke A, Albrich WC, et al. Blood biomarkers for personalized treatment and patient management decisions in community-acquired pneumonia. Curr Opin Infect Dis 2013;26(2):159-67. ↩︎ ↩︎ ↩︎ ↩︎
Muller F, Christ-Crain M, Bregenzer T, et al. Procalcitonin levels predict bacteremia in patients with community-acquired pneumonia: a prospective cohort trial. Chest 2010;138(1):121-9. ↩︎ ↩︎
Schuetz P, Wirz Y, Sager R, et al. Procalcitonin to initiate or discontinue antibiotics in acute respiratory tract infections. Cochrane Database Syst Rev 2017;10:Cd007498. ↩︎ ↩︎
Ruuskanen O, Lahti E, Jennings LC, et al. Viral pneumonia. Lancet 2011;377(9773):1264-75. ↩︎
Huang DT, Angus DC, Kellum JA, et al. Midregional proadrenomedullin as a prognostic tool in community-acquired pneumonia. Chest 2009;136(3):823-31. ↩︎
Struck J, Tao C, Morgenthaler NG, et al. Identification of an Adrenomedullin precursor fragment in plasma of sepsis patients. Peptides 2004;25(8):1369-72. ↩︎
Cavallazzi R, El-Kersh K, Abu-Atherah E, et al. Midregional proadrenomedullin for prognosis in community-acquired pneumonia: a systematic review. Respir Med 2014;108(11):1569-80. ↩︎ ↩︎
Kruger S, Ewig S, Giersdorf S, et al. Cardiovascular and inflammatory biomarkers to predict short- and long-term survival in community-acquired pneumonia: Results from the German Competence Network, CAPNETZ. Am J Respir Crit Care Med 2010;182(11):1426-34. ↩︎ ↩︎
Baron EJ, Miller JM, Weinstein MP, et al. A guide to utilization of the microbiology laboratory for diagnosis of infectious diseases: 2013 recommendations by the Infectious Diseases Society of America (IDSA) and the American Society for Microbiology (ASM)(a). Clin Infect Dis 2013;57(4):e22-e121. ↩︎ ↩︎ ↩︎
Afshar N, Tabas J, Afshar K, et al. Blood cultures for community-acquired pneumonia: are they worthy of two quality measures? A systematic review. J Hosp Med 2009;4(2):112-23. ↩︎
Fishman JA. Infection in solid-organ transplant recipients. N Engl J Med 2007;357(25):2601-14. ↩︎
Letourneau AR, Issa NC, Baden LR. Pneumonia in the immunocompromised host. Curr Opin Pulm Med 2014;20(3):272-9. ↩︎
Leoni D, Rello J. Severe community-acquired pneumonia: optimal management. Curr Opin Infect Dis 2017;30(2):240-7. ↩︎
Horita N, Miyazawa N, Kojima R, et al. Sensitivity and specificity of the Streptococcus pneumoniae urinary antigen test for unconcentrated urine from adult patients with pneumonia: a meta-analysis. Respirology 2013;18(8):1177-83. ↩︎
Sinclair A, Xie X, Teltscher M, et al. Systematic review and meta-analysis of a urine-based pneumococcal antigen test for diagnosis of community-acquired pneumonia caused by Streptococcus pneumoniae. J Clin Microbiol 2013;51(7):2303-10. ↩︎
Klugman KP, Madhi SA, Albrich WC. Novel approaches to the identification of Streptococcus pneumoniae as the cause of community-acquired pneumonia. Clin Infect Dis 2008;47 Suppl 3:S202-6. ↩︎
Bonten MJ, Huijts SM, Bolkenbaas M, et al. Polysaccharide conjugate vaccine against pneumococcal pneumonia in adults. N Engl J Med 2015;372(12):1114-25. ↩︎
Shimada T, Noguchi Y, Jackson JL, et al. Systematic review and metaanalysis: urinary antigen tests for Legionellosis. Chest 2009;136(6):1576-85. ↩︎
Phin N, Parry-Ford F, Harrison T, et al. Epidemiology and clinical management of Legionnaires' disease. Lancet Infect Dis 2014;14(10):1011-21. ↩︎
Mercante JW, Winchell JM. Current and emerging Legionella diagnostics for laboratory and outbreak investigations. Clin Microbiol Rev 2015;28(1):95-133. ↩︎
Wunderink RG, Waterer GW. Clinical practice. Community-acquired pneumonia. N Engl J Med 2014;370(6):543-51. ↩︎