第三章:院內型肺炎
3-1 常見菌種及流行病學
重點提要
台灣院內型肺炎細菌基本上是以綠膿桿菌(P. aeruginosa)和克雷伯氏菌(Klebsiella spp.)居多,這樣的趨勢與歐美國家最常見菌種為金黃色葡萄球菌不同,而且這些細菌對 carbapenem 類的抗藥性呈現逐年上升的趨勢,至於多重抗藥菌種的危險因子大體上與國外相差不多,包含有過去最近曾接受過廣效性靜脈注射抗生素治療、反覆住院、較長的住院天數、臨床嚴重度高、腫瘤病患等等。
主編:薛博仁
副編:彭萬誠
一、台灣院內感染監視資訊系統(TNIS)肺炎前十名菌種抗藥性分析
加入書籤
院內型肺炎細菌出現的相對機率,因病人特性、住院長短、是否曾使用抗生素、診斷的工具等因素影響,差異相當大。常見致病菌如抗甲氧苯青黴素金黃色葡萄球菌(methicillin-resistant Staphylococcus aureus, MRSA)、綠膿桿菌(Pseudomonas aeruginosa)、鮑氏不動桿菌(Acinetobacter baumannii)、腸道菌屬(Enterobacteriaceae spp.)。而在低免疫力宿主肺部之常見致病菌,像癌症相關低白血球症(cancer-related neutropenia)病人常見致病菌有 P. aeruginosa、 MRSA、肺炎克雷伯氏菌(Klebsiella pneumoniae)及黴菌(fungi)。
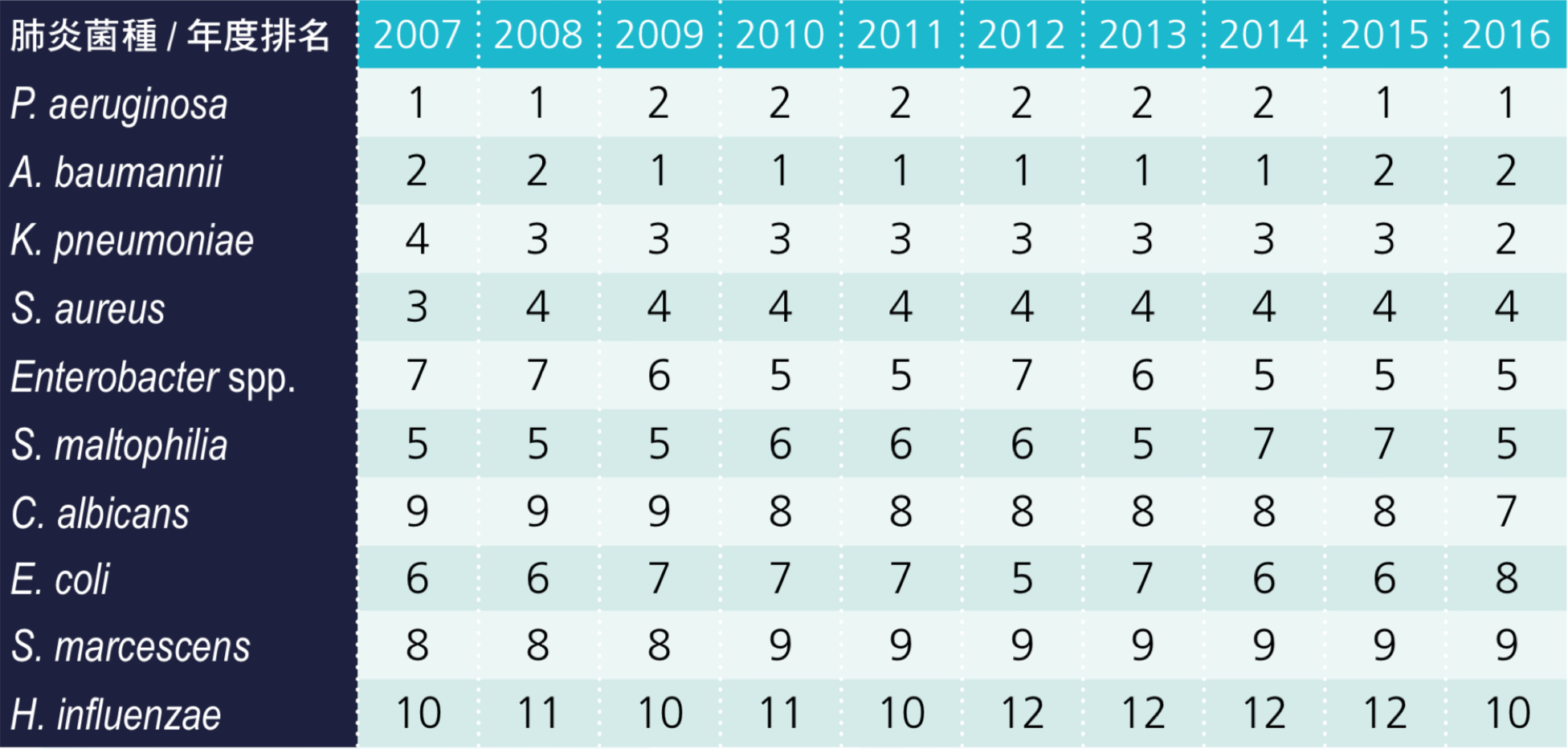
台灣院內感染監視資訊系統(TNIS)公佈,2016 年醫學中心加護病房院內型肺炎菌種有 P. aeruginosa、K. pneumoniae、A. baumannii、S. aureus、嗜麥芽窄食單胞菌(Stenotrophomonas maltophilia)、Enterobacter spp.、大腸桿菌(Escherichia coli)、粘質沙雷氏菌(Serratia marcescens)、腦膜敗血伊莉莎白菌(Elizabethkingia meningoseptica)及產吲哚金黃桿菌(Chryseobacterium indologenes),而前3名依序為 P. aeruginosa、K. pneumoniae 及 A. baumannii。醫學中心加護病房院內型肺炎菌種 C. indologenes 則由 2007 年的第 16 名上升至 2016 年的第 10 名;S. marcescens 排名由 2007 年的第 10 名上升至 2016 年的第 7 名,A. baumannii 則由 2007 年的第 1 名下降至 2016 年的第 3 名(如表 3.1.1)[1]。以 2010 年和 2015 年為例,P. aeruginosa、A. baumannii 及 K. pneumoniae 這 3 種細菌都佔所有菌種的一半以上,(圖 3.1.1、圖 3.1.2)比較大的變化是 A. baumannii 減少了 10% 左右的佔比 [2]。
而 2016 年區域醫院加護病房院內型肺炎菌種有 P. aeruginosa、A. baumannii、 K. pneumoniae、S. aureus、Enterobacter spp.、S. maltophilia、白色念珠菌(Candida albicans)、E. coli、S. marcescens 及流感嗜血桿菌(Haemophilus influenza),而前 3 名依序為 P. aeruginosa、A. baumannii 及 K. pneumoniae。區域醫院加護病房醫療照護相關肺炎菌種 K. pneumoniae 則由 2007 年的第 4 名上升至 2016 年的第 2 名;C. albicans 排名由 2007 年的第 9 名上升至 2016 年的第 7 名(如表 3.1.2)[2]。
表 3.1.1 2007 年至 2016 年醫學中心加護病房肺炎之感染菌種排名
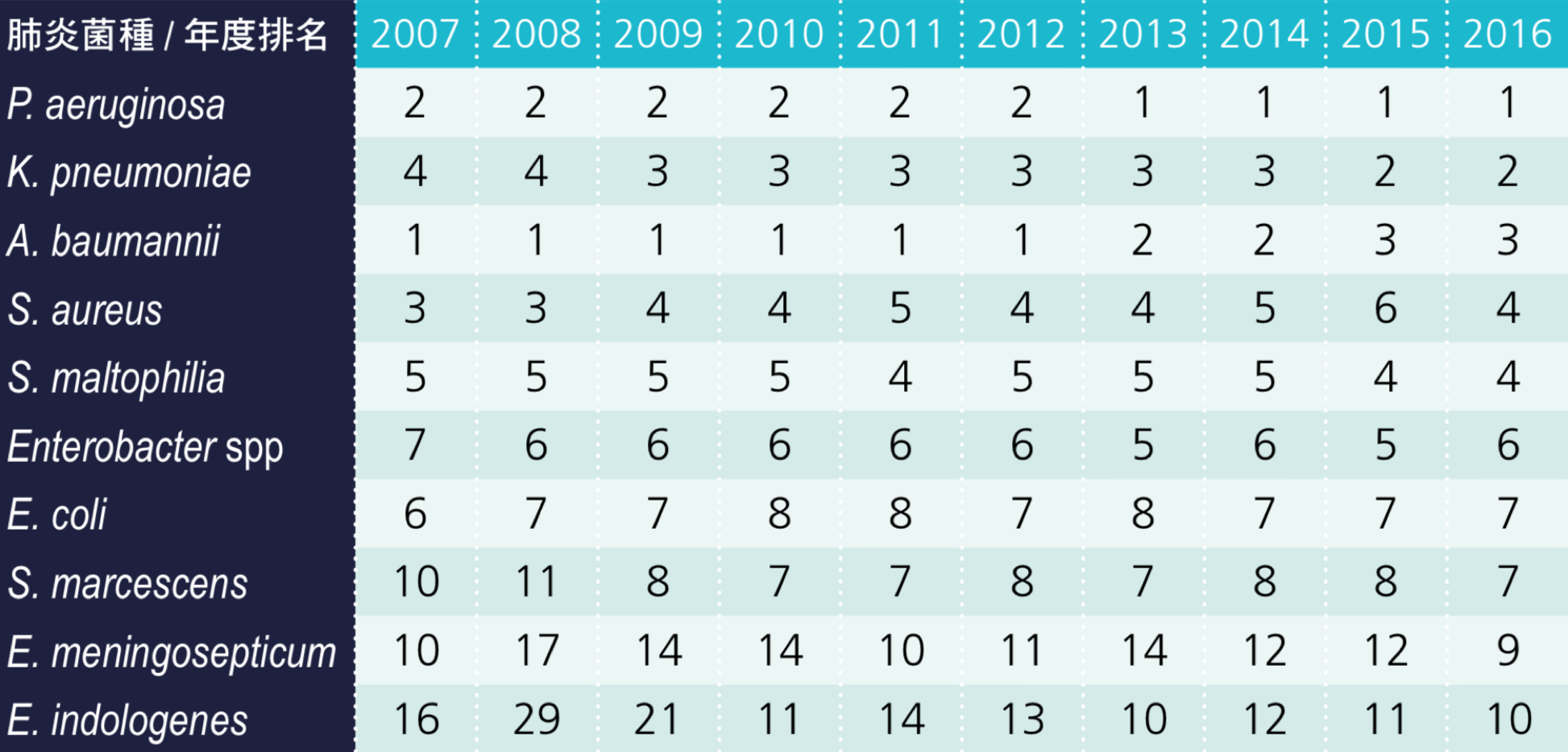
表 3.1.2 2007 年至 2016 年區域醫院加護病房肺炎之感染菌種排名
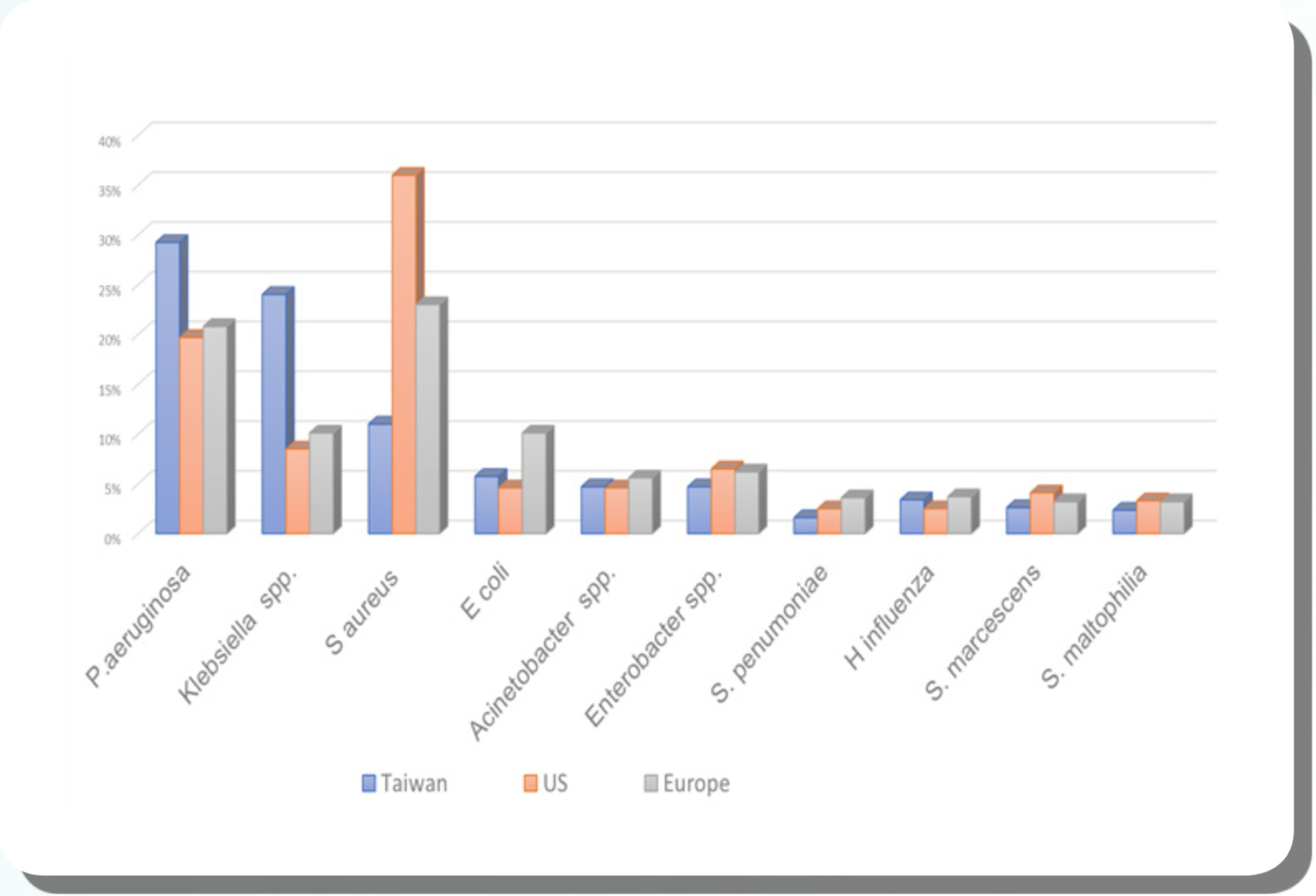
以上的統計與台灣 2007 年北中南 6 家醫學中心回溯性研究類似 [3],基本上是 以 P. aeruginosa 和 Klebsiella spp. 居多,這樣的趨勢在美國全國院內感染監測(National Nosocomial Infection Surveillance, NNIS)以及 SENTRY 菌種抗藥性監測,第一名的菌種都為金黃色葡萄球菌,可以高達 30%。在台灣的統計大約都是 10% 的比率。在歐洲與拉丁美洲,金黃色葡萄球菌的佔比大約 20~23% [4]。以台灣發表的文獻和類似年代在歐美的分析 [4],發現比較不同的比率除了金黃色葡萄球菌比較少以外,台灣有較高的比率為克雷伯氏菌屬(Klebsiella spp.)(圖 3.1.3)。 我們另外收集台大,三總,成大,奇美,慈濟,高醫等 6 家醫院 2016 全年與 2017 上半年主要病原菌在院內感染的抗藥性比率,在下面各細菌敘述做為參考,但是醫師用藥考量仍須以各醫院之流行病學為參考。以下針對常見院內感染菌株做一簡單介紹。
圖 3.1.1 2010年醫學中心加護病房院內型肺炎菌種 [2]
圖 3.1.2 2015年醫學中心加護病房院內型肺炎的菌種 [2]
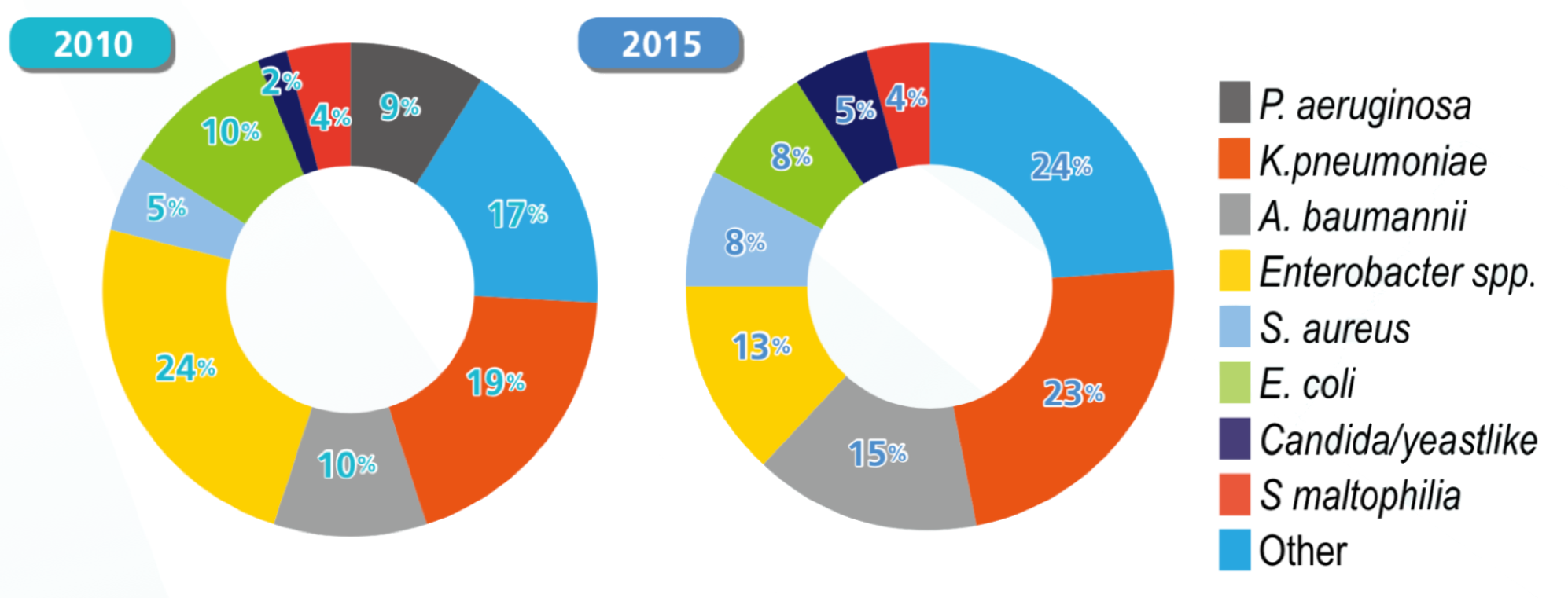
圖 3.1.3 台灣院內型肺炎菌種與歐美監測的比較
二、常見菌種個論
加入書籤
(一)綠膿桿菌(Pseudomonas aeruginosa)
P. aeruginosa 是重要院內感染致病菌,為革蘭氏陰性、好氧、長棒形的細菌,可分泌綠膿菌素(呈青色)、螢光素(呈螢光黃色)及綠膿菌紅素(呈啡紅色)等多種色素,廣泛地存在土壤、污水或潮濕環境中,此菌為院內感染常見的菌叢之一,屬於伺機性病原菌,可以感染任何部位,易造成肺炎、心內膜炎及燙傷傷口、泌尿道、腸胃道與血流感染,死亡率高達 30∼60%。依據美國疾病管制局估計在美國每年有 51,000 例與醫療相關的 P. aeruginosa 感染。 這些感染中有 6000 多例(13%)是多重抗藥的,綠膿桿菌有形成生物膜(biofilm)的特性,致使其對許多抗生素皆具有抗藥性,因此一般臨床上的治療須由實驗室敏感性測試結果協助用藥。碳青黴烯類抗生素(carbapenem)是臨床上治療綠膿桿菌的主要抗生素之一。但近年來許多國家,如日本、義大利、法國、英國、美國等,皆發現有越來越多的綠膿桿菌菌株對 carbapenem 類的抗生素產生抗藥性,對臨床治療造成莫大的衝擊。根據台灣院內感染監測系統 2016 年資料顯示,院內感染個案分離之 P. aeruginosa ,醫學中心加護病房對 carbapenem 類抗生素的 抗藥性比例(carbapenem-resistant P. aeruginosa)從 2007 年的 16.5%,逐年上升至 2017 年第三季 19.8%,區域醫院加護病房從 2007 年的 15.9% 下降至 2017 年 15.1%。統計 105 年至 106 年上半年六家醫院醫療照護相關感染之 P. aeruginosa 對 imipenem 抗生素的抗藥性比例為 18.2%,與前述 TNIS 數據比較,imipenem-resistant P. aeruginosa 的比率顯示持續上升,對 gentamicin 抗藥性為 7.4%,對 amikacin 抗藥性 2.0%,對 ceftazidime 抗藥性 12.4%,對 cefepime 抗藥性 21.7%,對 piperacillin/tazobactam 抗藥性 19.8%,對 levofloxacin抗 藥性15.8%,對 ciprofloxacin 抗藥性 13.0%。
P. aeruginosa 是醫院內常見感染的致病原,特別容易發生在嗜中性白血球低下的病人及使用呼吸器的病人。P. aeruginosa 的臨床徵候與其他化膿性細菌或 Legionella 相似,並且沒有特別的臨床徵候能夠區分 P. aeruginosa 感染。急性 P. aeruginosa 引起的肺炎通常伴有咳嗽合併膿痰、呼吸困難、發熱、寒戰、意識模糊以及嚴重的全身性毒性。根據一項研究顯示,引起 P. aeruginosa 肺炎較常發生 於高齡、長時間使用呼吸器、使用抗生素的住院病人、從醫療單位或重症加護病房轉進的病人、及入住於 P. aeruginosa 高危險群患者的病房 [5]。在胸腔影像方面,P. aeruginosa 引起的肺炎並沒有特殊的影像特徵。可能呈現瀰漫性雙側浸潤,伴有或不伴有肋膜積水。甚至,許多人會呈現多發性肺泡氣腔空間堅實化(multifocal airspace consolidation)影像,或是呈現結節狀浸潤、tree-in-bud opacities、和壞死的影像。
(二)肺炎克雷伯氏菌(Klebsiella pneumoniae)
K. pneumoniae 為革蘭氏陰性桿菌,屬於腸內菌科、克雷伯氏菌屬,普遍存在環境中,是一伺機性病原菌,對免疫力低弱的病人會造成嚴重感染,可引起肺炎、尿道感染、菌血症、腦膜炎、肝膿瘍及傷口感染等,是院內感染常見的菌種之一;在台灣,尤其好發於糖尿病的病人,是造成肝膿瘍的病源。此菌會分泌大量的胞外黏多醣,形成莢膜包覆菌體,使該菌具有抵抗白血球吞噬及補體系統之殺菌的能力。根據台灣院內感染監測系統 2016 年資料顯示,院內感染個案分離之 K. pneumoniae,醫學中心加護病房對 carbapenem 類的抗藥性(CRKP: carbapenem-resistant K. pneumoniae)比例從 2007 年的 4.6%,逐年上升至 2017 年第三季 29.9%,區域醫院加護病房從 2007 年的 2.8% 上升至 2017 年的 22.3%,但是統計 105 年至 106 年上半年六家醫院醫療照護相關感染之 K. pneumoniae 對 imipenem 抗生素的抗藥性比例為 7.1%,與前述 TNIS 之 CRKP 數據比較差異較大,其它對 gentamicin 抗藥性為 35.7%,對 amikacin 抗藥性為 6.9%,對 ampicillin/sulbactam 抗藥性 54.1%,對 ceftazidime 抗藥性 39.9%,對 cefepime 抗藥性 29.3%,對 piperacillin/tazobactam 抗藥性 28.3%,對 levofloxacin 抗藥性 32.3%,對 ciprofloxacin 抗藥性 32.0%,對 flomoxef 抗藥性 6.0%,對 trimethoprim-sulfamethoxazole(TMP-SMX)抗藥 46.9%。
K. pneumoniae 為肺部感染常見有肺炎合併呼吸衰竭及急性呼吸窘迫症等嚴重病情 [6][7],肺膿瘍在台灣也很常見,一項 1995 至 2003 年的 90 位肺膿瘍住院病人 的研究,K. pneumoniae 佔 25% [8],並且與糖尿病有關;胸部 X 光有時可見多處開洞,可能與台灣的毒性菌種有關 [9];另外在台灣 171 位急性膿胸的研究中,K. pneumoniae 佔 24% 最多,且與糖尿病有關 [10]。
K. pneumoniae 肺炎的臨床徵候有突發性呼吸困難、發燒、畏寒、咳嗽咳痰,尤其是住院或有慢性病的老人,另外,常見有肋膜性胸痛、呼吸加快,痰液部分有肺部發炎壞死所導致的濃膠狀含血絲痰,意即黑醋栗果凍 “currant jelly" 痰液;聽診有濕囉音,血液中白血球上升伴隨著不成熟的顆粒性白血球增加,嗜中性白血球過低是不好的徵候;在影像方面,大葉型肺炎較常見於社區型 [11][12][13],好發於右上肺葉後段,因強烈實質化將肺裂彎曲向下,稱作 “bulging fissure sign" [13],電腦斷層影像常見有毛玻璃狀斑塊(ground glass opacities)、肺泡實質化、肺葉內網狀斑塊(intralobar reticular opacities)、肋膜積液等等 [11];感染嚴重者,肺泡間隔的感染破壞會導致多處開洞,甚者,大葉性壞死(lobar gangrene),壞死性肺炎復原後可能併發殘留的肺纖維化,未封閉的開洞,以及肺功能下降。
(三)鮑氏不動桿菌(Acinetobacter baumannii)
A. baumannii 院內感染在國內醫療院所相當常見,也是最可能有多重抗藥性。鮑氏不動桿菌能在環境長時間存活,也是引起院內群突發最重要的致病菌之一。院內感染源於污染的環境或由帶菌者的手散播。此病菌可以在乾燥的表面存活很久,也是健康人手上呈現帶菌狀態的唯一革蘭氏陰性桿菌。許多臨床分離菌呈現移生狀態而不一定是該疾病之致病菌,但是此菌可以引起嚴重、甚至致命的感染,基於上述的微生物特性,多重抗藥性鮑氏不動桿菌(multidrug-resistant A. baumannii, MDRAB),甚至廣泛抗藥性鮑氏不動桿菌(extensively drug-resistant A. baumannii, XDRAB)已成為感染管制及臨床治療上的重大挑戰。根據台灣院內感染監測系統 2016 年資料顯示,醫療照護相關感染個案分離之 A. baumannii ,醫學中心加護病房對 carbapenem 類抗生素的抗藥性 比例從 2007 年的 48.1%,逐年上升至 2017 年 71.9% ,區域醫院加護病房從 2007 年的 56.9% 上升至 2017 年 70.7%,但是統計 105 年至 106 年上半年六家醫院醫療照護相關感染之 A. baumannii 對 imipenem 抗生素的抗藥性比例為 37.8%,其它對 gentamicin 抗藥性為 41.0%,對 amikacin 抗藥性為 23.5%,對 ampicillin/sulbactam 抗藥性 29.3%,對 ceftazidime 抗藥性 52.4%,對 cefepime 抗藥性 41.0%,對 piperacillin/tazobactam 抗藥性 48.2%,對於 cefoperazone/sulbactam 抗藥性 為38%,對 levofloxacin 抗藥性 42.3%,對 ciprofloxacin 抗藥性 43.2%,對 tigecycline 抗藥性 11.0%,對 TMP-SMX 抗藥性 51.7%。
Acinetobacter spp. 一般情況下不易引起疾病,但卻容易造成住院病患的伺機性感染,尤其是免疫力低下和重症加護病房病患。至目前為止,已有 50 多種不同菌種之 Acinetobacter spp. 被發現,其中最容易引起感染的是 A. baumannii 接著是 A. calcoaceticus 和 A. lwoffii。Acinetobacter 通常與人類共生存在,然而,在隨後的幾十年裡,使用呼吸器、放置中心靜脈導管和尿管、抗生素治療等引起 Acinetobacter spp. 感染有日益增加的趨勢。Acinetobacter spp. 感染已經在全球各地的醫院迅速傳播,最容易造成感染的地方是重症加護病房 [14]。在亞洲和某些拉美國家,Acinetobacter spp. 是三個最常見引起菌血症和院內感染肺炎的原因之一 [15][16][17][18][19]。另外,A. baumannii 的兩種最常見的臨床徵候也是引起院內感染肺炎和菌血症。引起院內感染肺炎大多是因為吸入的原因所造成 [2][20]。而 A. baumannii 造成的血流感染常見的原因是放置中心靜脈導管,其次是因為肺炎所導致,促進傳播 [21]。Acinetobacter spp. 造成的院內感染肺炎,其臨床徵候跟一般的院內感染肺炎類似,包含喘、發燒、心跳變快、痰變多、咳血等;在影像方面會呈現新的浸潤情形。
(四)金黃色葡萄球菌(Staphylococcus aureus)
S. aureus 隸屬於革蘭氏陽性球菌,普遍存在於自然環境中,為人體皮膚表面及上呼吸道黏膜的正常菌叢之一,能伺機地引起機緣性感染,引起的症狀包括皮膚的膿瘍(abscess),心內膜炎(endocarditis)、骨髓炎(osteomyelitis)、肺炎(pneumonia),甚至引起菌血症(bacteremia)或敗血性休克(septic shock)而造成死亡以及因產生腸毒素而造成食物中毒,是臨床上重要的致病菌之一。1990 年代起,MRSA 出現的比例開始上升,成為全球發生率最高的院內感染菌之一。根據台灣院內感染監測系統 2016 年資料顯示,醫學中心加護病房對 oxacillin 具抗藥性比例從 2007 年的 83.7%,逐年下降至 2017 年 64.8%,區域醫院加護病房從 2007 年的 81.8% 下降至 2017 年 64.4%。統計 105 年至 106 年上半年六家醫院醫療照護相關感染之 S. aureus 對 oxacillin 抗生素的抗藥性比例(ORSA)為 48.9%,其它對 gentamicin 抗藥性為 45.0%,對 tigecycline 抗藥性 0%,對 trimethoprim-sulfamethoxazole 抗藥性 14.2%。
S. aureus 常見的肺部感染有呼吸器相關肺炎,肺炎可見斑塊分節性的實質化合併肺容積減少,肺實質化也可能快速擴散融合成大葉性肺炎,可能影響幾個肺葉也可以是對稱性影響,局部併發症也有膿胸、肺膿瘍 [13];S. aureus 肺炎可伴隨病毒性肺炎之後發生,流感併發細菌性肺炎徵候有復發性高燒、咳嗽、咳濃痰、胸部 X 光可見新的發炎浸潤,年輕族群流感後爆發 MRSA 肺炎,會有高死亡率 [22]。
S. aureus 的臨床徵候有發燒、呼吸困難、濃痰,尤其是住院病人的吸入性肺炎,S. aureus 源自上呼吸道 [23],聽診有濕囉音和呼吸聲減弱,血液中白血球增加(>15,000 cells/mm3)伴隨著嗜中性白血球增多 [23];在影像方面,胸部 X 光以吸入性肺炎中間型(central)或分節性(segmental)肺部發炎浸潤或實質化較常見,也可見肋膜積水,較嚴重者會壞死性(necrotizing)肺炎伴隨著發高燒 [13];另外,在靜脈注射相關的 S. aureus 感染右側心內膜炎合併敗血性肺栓塞(septic emboli)則是經由血流傳遞轉移性感染,其徵候有發燒、胸痛、咳血,血液培養陽性,甚至血尿、貧血、腎功能異常,胸部 X 光可見多發性(multifocal)、散在性(discrete)、偏好下肺葉的界線不明結節狀肺斑塊、肺開洞、膿瘍、梗塞,電腦斷層常見支配周邊肺實質化的血管稱作 “feeding vessel sign" [13]。
(五)大腸桿菌(Escherichia coli)
E. coli 是人和動物腸道中最著名的一種細菌,主要寄生於大腸內 [24],約占腸道菌中的 1%。是一種兩端鈍圓、能運動、無芽孢的革蘭氏陰性短桿菌,根據台灣院內感染監測系統 2016 年資料顯示,醫療照護相關感染個案分離之 E. coli 對 carbapenem 具抗藥性(carbapenem-resistant E. coli ),醫學中心加護病房 CR E. coli 比例從 2007 年的 0.7%,逐年上升至 2017 年 3.9%,區域醫院加護病房從 2007 年的 1.3% 上升至 2017 年 2.7%,統計 105 年至 106 年上半年六家醫院醫療照護相關感染之 Escherichia coli 對 imipenem 抗生素的抗藥性比例為 1.2%,其它對 gentamicin 抗藥性為 42.7%,對 amikacin 抗藥性為 1.1%,對 ceftriaxone 抗藥性為 49.6%,對 ampicillin/sulbactam 抗藥性 69.0%,對 ceftazidime 抗藥性 40.3%,對 cefepime 抗藥性 33.3%,對 piperacillin/tazobactam 抗藥性 27.5%,對 levofloxacin 抗藥性 44.6%,對 ciprofloxacin 抗藥性 44.4%,對 TMP-SMX 抗藥性 60.1%。
E. coli 比較少造成社區型肺炎,但根據研究顯示,E. coli 在院內感染引起的肺炎卻佔有重要的角色 [4]。E. coli 造成肺炎的臨床徵候主要是以發燒、呼吸喘為主。另外,E. coli 也是多重抗藥性菌的重要成員,而大腸桿菌相關的多重抗藥性革蘭氏陰性菌,會造成病人有較差的預後,甚至增加死亡率 [25]。
(六)粘質沙雷氏菌(Serratia marcescens)
S. marcescens 為嗜氧性革蘭氏陰性桿菌,屬於 Enterobacteriaceae(腸桿菌科)的菌種,此菌偏好潮濕的環境,是造成院內感染重要的伺機性病源菌,在醫院環境中,S. marcescens 曾經從醫療用紗布、支氣管鏡、黏貼膠帶、蒸餾水、注射液的塑膠瓶蓋、導尿管、呼吸治療裝置、心電圖儀器的吸球、靜脈注射液等各類醫療儀器及材料分離出來,因此,S. marcescens 有機會引起院內感染群突發,特別對免疫耗弱的病人,引發的感染症包括:泌尿道感染、傷口感染、呼吸道感染、肺炎、菌血症、結膜炎、心內膜炎等,統計 105 年至 106 年上半年六家醫院醫療照護相關感染之 S. marcescens 對 imipenem 抗生素的抗藥性比例為 8.5%,其它對 gentamicin 抗藥性為 22.8%,對 amikacin 抗藥性為 9.4%,對 ceftriaxone 抗藥性為 26.3%,對 ceftazidime 抗藥性 17.8%,對 cefepime 抗藥性 12.0%, 對 piperacillin/tazobactam 抗藥性 12.3%,對 levofloxacin 抗藥性 24.3%,對 ciprofloxacin 抗藥性 22.2%,對 TMP-SMX 抗藥性 12.2%。
S. marcescens 肺部感染常見的有院內型肺炎、呼吸器肺炎,在美國呼吸器肺炎統計為第七名 [14][26]。S. marcescens 肺炎的臨床徵候與 K. pneumoniae 相似,依照院內型肺炎、呼吸器相關肺炎的定義,新的肺部發炎浸潤合併有新發生的發燒、濃痰、白血球增加、以及缺氧。其他的臨床徵候有心跳加快、呼吸加快、呼吸窘迫,痰液部分偶有粉紅或紅色,是細菌的色素(稱作假性咳血 pseudohemoptysis)[23],然而院內型的菌株通常不是紅色的,較常是乳白至淺灰色;在影像方面常見兩側下肺葉支氣管肺炎,有時會融合成大葉性肺炎,也可能併發肺膿瘍及/或膿胸 [13],感染嚴重者,與 K. pneumoniae 相同會開洞、大葉性壞死、肺纖維化、肺功能下降 [23]。
(七)腸內菌屬(Enterobacter spp.)
Enterobacter spp. 為可活動的革蘭氏陰性桿菌,屬於腸內菌屬(Enterobacteriaceae),臨床上常見的菌株包括 Enterobacter cloacae、E. aerogenes、E. agglomerans、E. sakazakii 等,其中 E. cloacae 最常被分離出。這群致病菌在一般人較少發生感染,但對於長期住院,特別是如護病房停留天數愈久、有較嚴重的潛在疾病者包括惡性腫瘤、燒傷病人或患有糖尿病者、或使用侵入性裝置、住院期間曾使用抗生素的病人及免疫機能發育不全的族群,如早產兒或低出生體重病嬰等,皆屬於易感族群 [27]。根據台灣院內感染監測系統 2016 年資料顯示,醫療照護相關感染個案分離之 Enterobacteriaceae 對 carbapenem 具抗藥性(CRE),醫學中心加護病房 CRE 比例從 2007 年的 3.1%,逐年上升至 2017 年 16.1%,區域醫院加護病房從 2007 年的 2.1% 上升至 2017 年 14.1%。統計 105 年至 106 年上半年六家醫院醫療照護相關感染之 E. cloacae 對 imipenem 抗生素的抗藥性比例為 8.2%,其它對 gentamicin 抗藥性為 8.3%,對 amikacin 抗藥性為 1.7%,對 ceftriaxone 抗藥性為 50%,對 ceftazidime 抗藥性 69.1%,對 cefepime 抗藥性 16.5%,對 piperacillin/tazobactam 抗藥性 26.8%,對 levofloxacin 抗藥性 43.8%,對 ciprofloxacin 抗藥性 20.6%,對 TMP-SMX 抗藥性 38.7%。
Enterobacter spp. 常見的致病菌是 E. aerogenes 和 E. cloacae;Enterobacter spp. 可造成泌尿道感染、菌血症,以及有抗藥性的院內型肺炎、呼吸器相關肺炎 [4]。Enterobacter spp. 肺炎的臨床徵候與 K. pneumoniae 相似,依照院內型肺炎、呼吸器相關肺炎的定義,新的肺部發炎浸潤合併有新發生的發燒、濃痰、白血球增 加、以及缺氧。
(八)嗜麥芽窄食單胞菌(Stenotrophomonas maltophilia)
S. maltophilia 為革蘭氏陰性桿菌,其主要生物特性為可在 MacConkey 培養基上生長,不產生氧化酶(oxidase)及無法使葡萄糖醱酵而產生能量。在自然環境中的水、土壤、植物、動物身上及醫院的環境中(如潮濕物表面),皆可發現 S. maltophilia 的蹤跡。在醫院中,S. maltophilia 易在長期住院病人的呼吸道,或在病人的人工植入物上形成移生菌落(colonizers),且在潮濕醫療器具表面上存活,再伺機侵入免疫能力低下的病人體內而造成感染 [28][29]。S. maltophilia 對許多抗生素先天上就有抗藥性,所以一旦在免疫能力低下的病人造成感染,治療上就倍加困難。S. maltophilia 對抗微生物藥劑的抗藥性大約有以下幾項:產生 β-lactamase 對 β-lactam 類抗生素抗藥性,細菌之排出(efflux)系統以致將進入細菌體內的抗生素排出,對 aminoglycoside 結構做酵素性修飾導致抗生素活性減少之抗藥性,透過 integron,transposon 或 plasmid 媒介使抗藥性基因,在不同細菌之間轉移導致細菌對 TMP-SMX 產生抗藥性,及形成生物膜(biofilm)阻卻抗生素滲入生物膜所保護的細菌。依據在台灣地區的 S. maltophilia 體外試驗結果,新一代的 fluoroquinolones(如 levofloxacin 或 moxifloxacin)有相當好的抗菌活性,可考慮做為經驗性的投藥。而 TMP-SMX 若抗藥性比率高則不適宜做為經驗性治療的給藥。其餘如一般常用抗生素,比如 aminoglycoside、carbapenem 對 S . maltophilia 抗菌活性不佳,臨床上不宜使用,統計 105 年至 106 年上半年六家醫院醫療照護相關感染之 S. maltophilia 對抗生素 TMP-SMX 的抗藥性比例為 14.5%,對 levofloxacin 抗生素的抗藥性比例為 16.0%。
S. maltophilia 感染最常見的臨床徵候是肺炎,接著是血流感染、傷口和泌尿道感染 [30]。S. maltophilia 引起的肺炎通常是院內感染引起的,最常發生於使用呼吸器的患者 [31]。
S. maltophilia 引起的肺炎臨床徵候並無特異性,大部分的病人會發燒,呼吸道徵候包括濃痰和呼吸急促。在影像方面,多為單側或雙側的小葉或大葉性肺炎,較少有肋膜積液和形成空洞的情形 [32]。
(九)念珠菌(Candida spp.)
Candida spp. 會造成局部性的表皮感染,還會引起致命的全身性感染。近年由於免疫系統缺陷患者,如:愛滋病患、化學治療或器官移植的病人、老年人、早產兒和糖尿病患的壽命延長,當其體內的抵抗力降低,或是念珠菌的數量大增的時候,原本正常的白色念珠菌就會成為致病菌而造成各種疾病,加上侵入性醫療器材的使用和抗生素的不當使用,使人體正常的細菌菌落被殺死,而使念珠菌的數目大增而成感染源,導致念珠菌感染在院內感染中成為不可被忽視的問題 [33]。這些念珠菌不但會造成局部性的表皮感染,還會引起致命的全身性感染。自 1989 年起,念珠菌已逐漸晉升為國內外院內常見的感染病原菌之一,查閱相關文獻發現,C. albicans 的分離率佔所有念珠菌之比率介於 37.5%~55.44%,第 2 位則是 C. tropicalis 介於 19.0%~25.8%,因此如何防治念珠菌感染已是一個刻不容緩的課題。
三、多重抗藥菌種的危險因子
加入書籤
院內型肺炎(含呼吸器相關肺炎)可能是由一些具有潛在抗藥性的菌株所引起,整體來說,過去 90 天曾接受過靜脈注射抗生素治療為抗藥性菌株引起的院內型肺炎的高危險群 [34],另外針對抗藥性菌株引起呼吸器相關肺炎的危險因子,包含有過去 90 天曾接受過靜脈注射抗生素治療、在發生呼吸器相關肺炎當下有敗血性休克、在發生呼吸器相關肺炎之前有急性呼吸窘迫症候群或接受過急性腎臟替代療法、在發生呼吸器相關肺炎之前有五天以上的住院 [34]。在一個台灣多中心的研究顯示:反覆住院、腫瘤病患及有神經疾病患者,均為抗藥性菌株相關肺炎的危險因子 [3]。其中最為常見的抗藥性的菌株,包含多重抗藥或碳青黴烯類抗藥綠膿桿菌(multidrug-resistant or carbapenem-resistant P. aeruginosa),產生廣效性內醯胺分解酶、碳青黴烯類抗藥肺炎克雷伯氏菌(extended-spectrum β-lactamase(ESBL)producing, carbapenem-resistant Klebsiella pneumoniae),多重抗藥鮑氏不動桿菌(multidrug-resistant Acinetobacter baumannii),methicillin-resistant S. aureus(MRSA),Stenotrophomonas maltophilia,_Chryseobacterium species,及 Elizabethkingia meningoseptica 等,以下將分別就此六種常見抗藥性菌株分別描述(附表 3.1.3)。
(一)多重抗藥性或碳青黴烯類抗藥綠膿桿菌(MDR- or carbapenem-resistant P. aeruginosa)
P. aeruginosa 是院內型肺炎常見的致病菌,然而在全球(包括台灣)有越來越多的變成多重抗藥性的菌株,針對 MDR-P. aeruginosa,有國外研究指出在最近 90 天內接受大於 24 小時的廣效性抗生素(如 carbapenem,fluoroquinolones,piperacillin-tazobactam ...等)、安養院住民、及罹患慢性肝病、糖尿病、需要住進加護病房等,均為得到 MDR-P. aeruginosa 感染的顯著危險因子 [35]。在台灣也有研究指出 carbapenem-resistant P. aeruginosa 與較長的住院天數,之前抗生素(尤其是 carbapenems)的使用有密切相關[23],也有文獻指出與之前使用 aminoglycoside 或 fluoroquinolone 治療有關 [36]。在美國感染症疾病學會(IDSA)與美國胸科學會(ATS)的指引中,則明訂過去 90 天曾接受過靜脈注射抗生素治療為 MDR-P. aeruginosa 的危險因子 [37]。另外,假如在單位的監測系統內顯示超過 10% 的 P. aeruginosa 對於有考慮要給予治療的單一抗生素有抗藥性,需視為 MDR-P. aeruginosa 的高危險群 [34]。
(二)會產生廣效性乙內醯胺分解酶及碳青黴烯類抗藥腸桿菌科細菌(ESBL-producing and carbapenem-nonsusceptible Enterobacteriaceae)
會產生 ESBL 的腸桿菌科細菌(尤其是 K. pneumoniae)引起的血流感染,已被證實會給患者帶來的死亡率,遠高於得到無 ESBL 的腸內菌感染的患者。值得注意 的是,自 2012 年以後,亞洲已經成為會產生 ESBL 的腸內菌高流行率的超大型中心,主要是和牽涉到複雜性腹腔內感染的重要腸桿菌科細菌(主要是 E. coli,K. pneumoniae,產酸克春白士氏菌(Klebsiella oxytoca))有關聯。儘管腸桿菌科的革蘭氏陰性菌種主要分佈在腹腔內,但其實它們也能夠存活在口咽部和呼吸道中。
很早之前已經發現,最近使用過第三代頭芽孢菌素,或 fluoroquinolone 類抗生素,明顯會使得住院患者在臨床上由比較容易得到會產生 ESBL 的腸桿菌科細菌的感染。另外,如果先前就已經有 K. pneumoniae 或 Enterobacter 屬的細菌的移生(colonization)在呼吸道中,也是比較容易得到會產生 ESBL 的腸桿菌引起的肺 炎的獨立預測因子(2B)[38]。從 2001 年以來,另一個值得關注的高度抗藥性問題,是關於會生產碳青黴烯酶(carbapenemase)的腸桿菌科細菌 [13]。除了會生產大量的 ESBL 或 AmpC β-lactamase 等類分解酶,加上有OmpK36細胞膜外通透隧道蛋白(outer-membrane porin)的功能障礙,導致對 carbapenem 類藥物(特別是 ertapenem)有抗藥性的腸桿菌科細菌之外 [39],台灣臨床環境當中,會產生 carbapenemase 的腸桿菌科細菌,比較常遇到的是 K. pneumoniae carbapenemase(KPC)-2型(隸屬於 Ambler A 類),特別是序列型 sequence type(ST)11(ST 11)的 K. pneumoniae 株,以及 imipenemase 類型分解酶的 IMP-8 型(隸屬於 Ambler B 類)[13][40],其中前者對 carbapenem 類藥物的抗藥程度遠高於後者 [13]。根據之前對得到會生產 KPC 且對於 carbapenem 類抗生素有抗藥性的 K. pneumoniae 菌株感染患者的調查,重症加護病房住院的患者(1B)[40],接受免疫抑制劑治療(2A)[41],和/或接受除 carbapenem 以外的廣效性 β-lactam 類藥物或者是 fluoroquinolone 類藥物(2C)[41],得到會產生 KPC 類型分解酶的 K. pneumoniae 細菌感染的風險最高。除了各種 KPC 類的分解酶之外,在亞洲也應該多加警惕的其他類型 carbapenemases 是新德里重金屬依賴性 β-lactamase(New Delhi metallo-β- lactamase(NDM),隸屬於 Ambler B 類)[41],特別是起源於印度次大陸的 NDM-1。在同一環境中,無論是在不同種的腸桿菌(K. pneumoniae,E. coli )之間藉由獨特插入因子(insertion elements),而不是整合子(integron)以及轉位酶(transpose)協助傳播合成 NDM-1 的抗藥性基因,或者是特殊單一攜帶有 NDM-1 類型的 carbapenem 分解酶抗藥性基因的菌株的傳播,都已經被證實的確會發生 [13]。因此,儘管除了接觸到相關患者外 [42],目前沒有其他危險因子被報導到會導致 得到能夠合成 NDM carbapenemase的 腸桿菌菌株,到目前為止,集中相關病患作預防性接觸隔離,可能才是防止其在臨床環境中擴散的最好方法。
(三)碳青黴烯類抗藥或廣泛抗藥性鮑氏不動桿菌(Carbapenem-resistant 或 extensively drug-resistant(XDR)- A. baumannii )
A. baumannii 對眾多不同類型抗生素的抗藥性的上升趨勢,在過去的十幾年中已成為臨床(尤其是重症加護單位)關注的重點 [39]。除了在機構內的某些部門內的不間斷的特定菌株的傳播之外 [43],在 A. baumannii 的質體上,攜帶有各種不同的 Ambler D 類 carbapenem 分解酶(包括 blaOXA-23,blaOXA-58,blaOXA-58-like,blaOXA-72 ... 等)的基因,會特別賦予臨床上的 A. baumannii 表現出對所有 carbapenem 類藥物 有高度抗藥性 [39]。許多後天性獲得的插入序列(insertion sequence)或轉位酶(transpose),已經被證明可以促進質體上的 blaOXA-58 基因在不動桿菌屬細菌上, 加強表現其抗藥性程度和擴散能力 [39]。此外,Charlson 共同病症指數 ≥ 4 [44][45],高 APACHE II 指數( ≥ 16)[45],或住院時間拖長( ≥ 14天)[44],或留置於重症加護病房時間的延長( ≥ 10天)(2B)[44][45],或先前使用某些廣效性抗菌譜抗生素,如 cefepime,piperacillin-tazobactam,或 carbapenem 類抗生素 [45]等,也有被報導認為可能與廣泛性抗藥 A. baumannii 引起的肺炎有關聯。
(四)抗甲氧西林金黃色葡萄球菌(MRSA)
在美國感染性疾病學會(IDSA)與美國胸科學會(ATS)的指引中則明訂過去 90 天曾接受過靜脈注射抗生素治為 MRSA 的危險因子 [34]。另外,假如在單位的監測系統內顯示超過 10~20% 的 S. aureus 為methicillin resistant,需視為 MRSA 的高危險群 [34]。有研究指出 較高的疾病嚴重度(APACHE II score),之前有使用過抗生素或接受手術,均為 MRSA 呼吸器相關肺炎的危險因子 [46]。另外在一個歐洲大規模的臨床行為問卷式調查顯示:若病患來自安養院,單位有超過 20% 的 MRSA 盛行率,遲發性的肺炎,之前有使用抗生素,或鼻咽有 MRSA 移生為 MRSA 感染的高危險群 [37]。
(五)嗜麥芽窄食單胞菌(S. maltophilia)
S. maltophilia 可以存活在幾乎任何潮濕的表面上,擁有形成生物膜的能力,以及使用多種機制來產生對許多抗微生物劑的抗藥性,已在近幾年被世界衛生組織歸類為主要的醫院多重抗藥性菌株之一,常見的危險因子,在一台灣收了 406 位 S. maltophilia 院內型肺炎病患的研究,也發現:六成以上的病患住過加護病房,在病發前平均住院天數高達 28 天住過加護病房,將近二分之一的患者有使用呼吸器,超過四分之一的病患合併有惡性腫瘤或糖尿病 [41]。
表 3.1.3 各個多重抗藥菌種的危險因子

四、參考文獻
加入書籤
Taiwan Centers for Disease Control. Annual Report of Nosocomial Infections Surveillance System (2016). Accessed Jan 27, 2018. ↩︎
Gil-Perotin S, Ramirez P, Marti V, et al. Implications of endotracheal tube biofilm in ventilator-associated pneumonia response: a state of concept. Crit Care 2012;16(3):R93. ↩︎ ↩︎ ↩︎ ↩︎ ↩︎
Wu CL, Ku SC, Yang KY, et al. Antimicrobial drug-resistant microbes associated with hospitalized community-acquired and healthcare-associated pneumonia: a multi-center study in Taiwan. J Formos Med Assoc 2013;112(1):31-40. ↩︎ ↩︎
Jones RN. Microbial etiologies of hospital-acquired bacterial pneumonia and ventilator-associated bacterial pneumonia. Clin Infect Dis 2010;51(Suppl 1):S81-7. ↩︎ ↩︎ ↩︎ ↩︎
Venier AG, Gruson D, Lavigne T, et al. Identifying new risk factors for Pseudomonas aeruginosa pneumonia in intensive care units: experience of the French national surveillance, REA-RAISIN. J Hosp Infect 2011;79(1):44-8. ↩︎
Lin YT, Jeng YY, Chen TL, et al. Bacteremic community-acquired pneumonia due to Klebsiella pneumoniae: clinical and microbiological characteristics in Taiwan, 2001-2008. BMC Infect Dis 2010;10:307. ↩︎
Lin YT, Wang YP, Wang FD, et al. Community-onset Klebsiella pneumoniae pneumonia in Taiwan: clinical features of the disease and associated microbiological characteristics of isolates from pneumonia and nasopharynx. Front Microbiol 2015;9:122. ↩︎
Wang JL, Chen KY, Fang CT, et al. Changing bacteriology of adult community-acquired lung abscess in Taiwan: Klebsiella pneumoniae versus anaerobes. Clin Infect Dis 2005;40(7):915-22. ↩︎
Yu WL, Ko WC, Cheng KC, et al. Association between rmpA and magA genes and clinical syndromes caused by Klebsiella pneumoniae in Taiwan. Clin Infect Dis 2006;42(10):1351-8. ↩︎
Chen KY, Hsueh PR, Liaw YS, et al. A 10-year experience with bacteriology of acute thoracic empyema: emphasis on Klebsiella pneumoniae in patients with diabetes mellitus. Chest 2000;117(6):1685-9. ↩︎
Okada F, Ando Y, Honda K, et al. Clinical and pulmonary thin-section CT findings in acute Klebsiella pneumoniae pneumonia. Eur Radiol 2009;19(4):809-15. ↩︎ ↩︎
Fiberesima FP, Onwuchekwa AC. Community acquired pneumonia in Port Harcourt Rivers State of Nigeria. Cent Afr J Med 2008;54(1-4):1-8. ↩︎
Jean SS, Lee WS, Lam C, et al. Carbapenemase-producing Gram-negative bacteria: current epidemics, antimicrobial susceptibility and treatment options. Future Microbiol 2015;10(3):407-25. ↩︎ ↩︎ ↩︎ ↩︎ ↩︎ ↩︎ ↩︎ ↩︎ ↩︎ ↩︎
Sievert DM, Ricks P, Edwards JR, et al. Antimicrobial-resistant pathogens associated with healthcare-associated infections: summary of data reported to the National Healthcare Safety Network at the Centers for Disease Control and Prevention, 2009-2010. Infect Control Hosp Epidemiol 2013;34(1):1-14. ↩︎ ↩︎
Chung DR, Song JH, Kim SH, et al. High prevalence of multidrug-resistant nonfermenters in hospital-acquired pneumonia in Asia. Am J Respir Crit Care Med 2011;184(12):1409-17. ↩︎
Kuo SC, Chang SC, Wang HY, et al. Emergence of extensively drug-resistant Acinetobacter baumannii complex over 10 years: nationwide data from the Taiwan Surveillance of Antimicrobial Resistance (TSAR) program. BMC Infect Dis 2012;12:200. ↩︎
Dejsirilert S, Tiengrim S, Sawanpanyalert P, et al. Antimicrobial resistance of Acinetobacter baumannii: six years of National Antimicrobial Resistance Surveillance Thailand (NARST) surveillance. J Med Assoc Thai 2009;92 Suppl 4:S34-45. ↩︎
Madani N, Rosenthal VD, Dendane T, et al. Health-care associated infections rates, length of stay, and bacterial resistance in an intensive care unit of Morocco: findings of the International Nosocomial Infection Control Consortium (INICC). Int Arch Med 2009;2(1):29. ↩︎
Luna CM, Rodriguez-Noriega E, Bavestrello L, et al. Gram-negative infections in adult intensive care units of Latin America and the Caribbean. Crit Care Res Pract 2014;2014:480463. ↩︎
Raad II, Mohamed JA, Reitzel RA, et al. The prevention of biofilm colonization by multidrug-resistant pathogens that cause ventilator-associated pneumonia with antimicrobial-coated endotracheal tubes. Biomaterials 2011;32(11):2689-94. ↩︎
Wong D, Nielsen TB, Bonomo RA, et al. Clinical and Pathophysiological Overview of Acinetobacter Infections: a Century of Challenges. Clin Microbiol Rev 2017;30(1):409-47. ↩︎
Schwarzmann SW, Adler JL, Sullivan RJ, Jr., et al. Bacterial pneumonia during the Hong Kong influenza epidemic of 1968-1969. Arch Intern Med 1971;127(6):1037-41. ↩︎
Lee CH, Su TY, Ye JJ, et al. Risk factors and clinical significance of bacteremia caused by Pseudomonas aeruginosa resistant only to carbapenems. J Microbiol Immunol Infect 2017;50(5):677-83. ↩︎ ↩︎ ↩︎ ↩︎ ↩︎
Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases E-Book. ed. Placed Published: Elsevier Health Sciences, Saunders.2014. ↩︎
Rodrigo-Troyano A, Sibila O. The respiratory threat posed by multidrug resistant Gram-negative bacteria. Respirology 2017;22(7):1288-99. ↩︎
Hidron AI, Edwards JR, Patel J, et al. NHSN annual update: antimicrobial-resistant pathogens associated with healthcare-associated infections: annual summary of data reported to the National Healthcare Safety Network at the Centers for Disease Control and Prevention, 2006-2007. Infect Control Hosp Epidemiol 2008;29(11):996-1011. ↩︎
孫淑美, 陳瑛瑛, 王復德. 某醫學中心新生兒加護病房院內感染Enterobacter species菌血症流行病學調查 (Epidemiology and Risk Factors for Nosocomial Enterobacter Bacteremia at Neonatal Intensive Care Unit in a Medical Center). 感染控制雜誌 (Infection Control J) 2009;19(2):81-9. ↩︎
Spencer RC. The emergence of epidemic, multiple-antibiotic-resistant Stenotrophomonas (Xanthomonas) maltophilia and Burkholderia (Pseudomonas) cepacia. J Hosp Infect 1995;30(Suppl):453-64. ↩︎
Senol E. Stenotrophomonas maltophilia: the significance and role as a nosocomial pathogen. J Hosp Infect 2004;57(1):1-7. ↩︎
Looney WJ, Narita M, Muhlemann K. Stenotrophomonas maltophilia: an emerging opportunist human pathogen. Lancet Infect Dis 2009;9(5):312-23. ↩︎
Saugel B, Eschermann K, Hoffmann R, et al. Stenotrophomonas maltophilia in the respiratory tract of medical intensive care unit patients. Eur J Clin Microbiol Infect Dis 2012;31(7):1419-28. ↩︎
Vartivarian SE, Anaissie EJ, Kiwan EN, et al. The clinical spectrum of Stenotrophomonas (Xanthomonas) maltophilia respiratory infection. Semin Respir Crit Care Med 2000;21(4):349-55. ↩︎
陳建源, 林明瀅, 施玲娜. 念珠菌檢驗及藥物敏感試驗方法之介紹. 感染控制雜誌 2006;16(5):283-93. ↩︎
Kalil AC, Metersky ML, Klompas M, et al. Management of Adults With Hospital-acquired and Ventilator-associated Pneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clin Infect Dis 2016;63(5):e61-e111. ↩︎ ↩︎ ↩︎ ↩︎ ↩︎
Fernandez-Barat L, Ferrer M, De Rosa F, et al. Intensive care unit-acquired pneumonia due to Pseudomonas aeruginosa with and without multidrug resistance. J Infect 2017;74(2):142-52. ↩︎
Lin KY, Lauderdale TL, Wang JT, et al. Carbapenem-resistant Pseudomonas aeruginosa in Taiwan: Prevalence, risk factors, and impact on outcome of infections. J Microbiol Immunol Infect 2016;49(1):52-9. ↩︎
Dryden M, Andrasevic AT, Bassetti M, et al. A European survey of antibiotic management of methicillin-resistant Staphylococcus aureus infection: current clinical opinion and practice. Clin Microbiol Infect 2010;16(Suppl 1):3-30. ↩︎ ↩︎
Razazi K, Mekontso Dessap A, Carteaux G, et al. Frequency, associated factors and outcome of multi-drug-resistant intensive care unit-acquired pneumonia among patients colonized with extended-spectrum beta-lactamase-producing Enterobacteriaceae. Ann Intensive Care 2017;7(1):61. ↩︎
Jean SS, Hsueh PR, Lee WS, et al. Carbapenem susceptibilities and non-susceptibility concordance to different carbapenems amongst clinically important Gram-negative bacteria isolated from intensive care units in Taiwan: results from the Surveillance of Multicentre Antimicrobial Resistance in Taiwan (SMART) in 2009. Int J Antimicrob Agents 2013;41(5):457-62. ↩︎ ↩︎ ↩︎ ↩︎
Chiu SK, Wu TL, Chuang YC, et al. National surveillance study on carbapenem non-susceptible Klebsiella pneumoniae in Taiwan: the emergence and rapid dissemination of KPC-2 carbapenemase. PLoS One 2013;8(7):e69428. ↩︎ ↩︎
Bratu S, Landman D, Haag R, et al. Rapid spread of carbapenem-resistant Klebsiella pneumoniae in New York City: a new threat to our antibiotic armamentarium. Arch Intern Med 2005;165(12):1430-5. ↩︎ ↩︎ ↩︎ ↩︎
Isozumi R, Yoshimatsu K, Yamashiro T, et al. bla(NDM-1)-positive Klebsiella pneumoniae from environment, Vietnam. Emerg Infect Dis 2012;18(8):1383-5. ↩︎
Hsueh PR, Teng LJ, Chen CY, et al. Pandrug-resistant Acinetobacter baumannii causing nosocomial infections in a university hospital, Taiwan. Emerg Infect Dis 2002;8(8):827-32. ↩︎
Lee YC, Huang YT, Tan CK, et al. Acinetobacter baumannii and Acinetobacter genospecies 13TU and 3 bacteraemia: comparison of clinical features, prognostic factors and outcomes. J Antimicrob Chemother 2011;66(8):1839-46. ↩︎ ↩︎ ↩︎
Li YJ, Pan CZ, Fang CQ, et al. Pneumonia caused by extensive drug-resistant Acinetobacter baumannii among hospitalized patients: genetic relationships, risk factors and mortality. BMC Infect Dis 2017;17(1):371. ↩︎ ↩︎ ↩︎ ↩︎
Bouza E, Giannella M, Bunsow E, et al. Ventilator-associated pneumonia due to meticillin-resistant Staphylococcus aureus: risk factors and outcome in a large general hospital. J Hosp Infect 2012;80(2):150-5. ↩︎